潘東青 薬学研究科助教、加藤博章 同教授、岩田想 医学研究科教授(理化学研究所グループディレクター)、中津亨 和歌山県立医科大学教授、中根崇智 大阪大学特任講師、南後恵理子 理化学研究所チームリーダー、登野健介 高輝度光科学研究センター主席研究員の研究グループは、SACLAの非常に強力なX線自由電子レーザー(XFEL)を用いたシリアルフェムト秒構造解析(SFX)により、様々ながんにおける多剤耐性の原因であり、医薬学研究において重要なABCトランスポーターの立体構造を2.22Åの高分解能で決定することに成功しました。
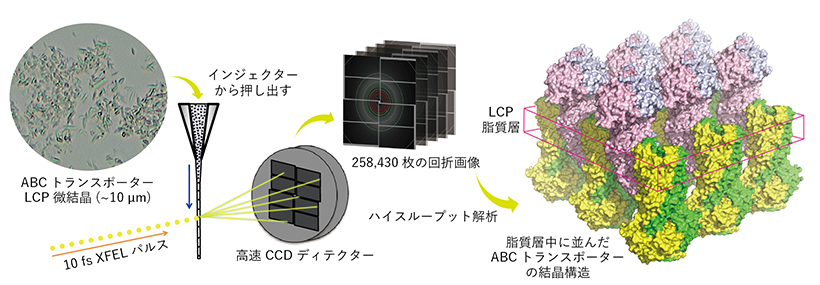
膜タンパク質の結晶を作る際、脂質キュービック相(LCP)法と、主に可溶性タンパク質で用いられている蒸気拡散法が用いられます。今回用いたABCB1のホモログであるCmABCB1は、すでに蒸気拡散法により結晶が得られていましたが、この結晶をSACLAに供しても高い分解能を示すX線回折像は得られませんでした。一方、LCP法は生体膜に深く埋め込まれた膜タンパク質の結晶化に優れた方法であっても適用範囲が限られており、ABCトランスポーターのように可溶性領域が膜外に大きくはみ出している構造の膜タンパク質にはほとんど用いられてきませんでした。そこで、LCPの調製方法を工夫し、通常のLCP法で用いる脂質である9.9MAG(モノオレイン)ではなく、7.7MAGというアシル鎖が短い脂質を使用したときに、より良好な微結晶(長辺10マイクロメーター程度)が得られることを発見しました。ただし、この結晶はスポンジ相という粘性が低い相で得られたため、測定のために結晶懸濁液の粘性を上げる必要がありました。そこで、23種類の増粘剤を試したところ、Hydroxypropyl methylcellulose(HPMC)が適していることがわかりました。最終的には17.5% HPMCを加えて測定した際に2.22Å分解能の外向き型の結晶構造を得ました。
この結果は、SACLAを使うことでCmABCB1の開閉運動をより詳しく解明できることを示唆しています。
本研究成果は、2021年12月23日に、国際学術誌「IUCrJ」にオンライン掲載されました。
【DOI】https://doi.org/10.1107/S2052252521011611
【KURENAIアクセスURL】http://hdl.handle.net/2433/266705
Dongqing Pan, Ryo Oyama, Tomomi Sato, Takanori Nakane, Ryo Mizunuma, Keita Matsuoka, Yasumasa Joti, Kensuke Tono, Eriko Nango, So Iwata, Toru Nakatsua, Hiroaki Katoa, (2022). Crystal structure of CmABCB1 multi-drug exporter in lipidic mesophase revealed by LCP-SFX. IUCrJ, 9(1), 134-145.





