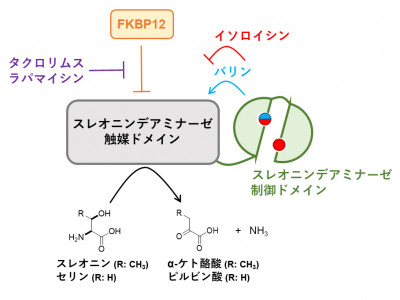
放線菌が産生するタクロリムス(FK506)やラパマイシンは免疫抑制剤や難治性リンパ管疾患治療薬として利用されており、それらは細胞内のタンパク質FKBP12に結合して作用を発揮することが知られています。FKBP12は真核生物に広く保存されていますが、その細胞内での本来の機能はあまりよく分かっていません。
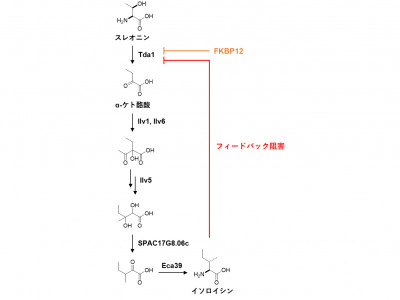
掛谷秀昭 薬学研究科教授は、佐々木舞雪 東京大学大学院生(研究当時)、西村慎一 同講師、吉田稔 同教授、理化学研究所らと共同研究を行い、分裂酵母においてFKBP12はアミノ酸の一種であるスレオニンの脱アミノ化を触媒するTda1タンパク質の機能を抑制し、それによりイソロイシンの生合成を抑制することを明らかにしました。イソロイシンの生合成経路はさまざまな因子により制御を受けることが知られていますが、FKBP12による抑制はこれまで知られていませんでした。
この発見は、FKBP12がイソロイシンの生合成酵素の活性を制御する役割を持つことを示すとともに、真菌にとって重要なイソロイシン生合成経路をヒトは持たないことから、新しい抗真菌剤の開発にもつながることが期待されます。
本研究成果は、2022年12月6日に、科学誌「iScience」オンライン版に掲載されました。
【DOI】
https://doi.org/10.1016/j.isci.2022.105659
【KURENAIアクセスURL】
http://hdl.handle.net/2433/277821
【書誌情報】
Mayuki Sasaki, Shinichi Nishimura, Yoko Yashiroda, Akihisa Matsuyama, Hideaki Kakeya, Minoru Yoshida (2022). FK506-binding protein, FKBP12, promotes serine utilization and negatively regulates threonine deaminase in fission yeast. iScience, 25(12):105659.





