上久保靖彦 医学研究科准教授、足立壮一 同教授、森田剣 同研究員、能浦三奈 同修士課程学生、杉山弘 理学研究科教授らの研究グループは、がん抑制遺伝子p53(TP53)と、転写因子RUNX1と結合するパートナータンパク質CBFBが、RUNX1-抑制を含む抗がん剤治療により順次増強されることにより、結果的に急性骨髄性白血病細胞に薬剤抵抗性が誘導されるというメカニズムを解明しました。
本研究成果は、2017年11月30日午後7時に英国の科学誌「Scientific Reports」に掲載されました。
研究者からのコメント
RUNX1などのαファミリー因子が白血病などの癌を進行させるという報告は近年増加傾向にあり、私たちが提唱しているRUNX1-抑制コンセプトは、新規抗腫瘍戦略として注目されています。今回は白血病で働いているフィードバック機構を発見しましたが、この種の仕組みはその他の癌でも存在していると考えられます。RUNX1-p53-CBFBフィードバックループは潜在的な難治性白血病治療ターゲットとなりうるため、今後引き続きフィードバックループをターゲットとした研究開発を進めていきます。
概要
転写因子Runt-related transcription factor 1(RUNX1)は、血を作るのに必要な遺伝子を一括して制御しています。白血病の発症や進行に重要な役割も担っているため、RUNX1抑制による白血病治療は有効な新規治療戦略であると広く認められつつあります。しかし、RUNX1の抑制やその他現在の抗がん剤治療に対して、白血病細胞がどのように耐性を獲得し治療効果が薄れていくのか、メカニズムはほとんど解明されていません。特にRUNX1と結合するパートナータンパク質CBFBは、抵抗性獲得にどのように関わっているのかほとんど分かっていませんでした。
RUNX1を抑制するとがん抑制遺伝子p53が活性化し、白血病細胞も抑えられるというメカニズムは既に報告されています。本研究グループは、がん抑制的転写因子p53が、CBFBの転写発現を制御する領域に直接結合してCBFBの発現を直接増加させ、結果的に転写因子RUNX1を再び安定化するフィードバック機構を発見しました。このループによりRUNX1は抑制されにくくなり、RUNX1の抑制や他の抗がん剤による抗白血病効果を弱くしてしまいます。多数の臨床例のサンプルを用いた既存データを解析すると、治療後再発した急性骨髄性白血病患者例では治療前初発診断時よりもCBFBの発現レベルが上昇しており、p53の発現量も同時に増えていました。これは、白血病発症や白血病細胞の増殖維持に、RUNX1-p53-CBFBフィードバックループが重要な働きをしていることを示唆する結果です。このフィードバックループを制御できれば、更に効果的な新規治療戦略が立てられると考えられます。
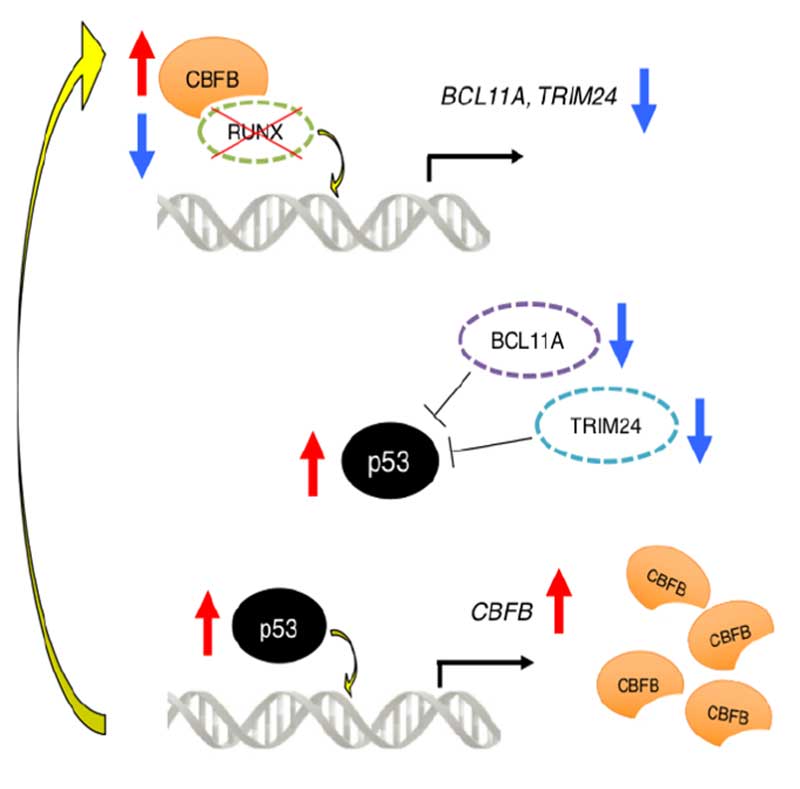
図:今回発見した耐性獲得に至るフィードバックループ
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1038/s41598-017-16799-z
【KURENAIアクセスURL】 http://hdl.handle.net/2433/228155
Ken Morita, Mina Noura, Chieko Tokushige, Shintaro Maeda, Hiroki Kiyose, Gengo Kashiwazaki, Junichi Taniguchi, Toshikazu Bando, Kenichi Yoshida, Toshifumi Ozaki, Hidemasa Matsuo, Seishi Ogawa, Pu Paul Liu, Tatsutoshi Nakahata, Hiroshi Sugiyama, Souichi Adachi & Yasuhiko Kamikubo(2017).
Autonomous feedback loop of RUNX1-p53-CBFB in acute myeloid leukemia cells. Scientific Reports, 7, 16604.
- 日刊工業新聞(12月1日 23面)に掲載されました。





