森博幸 ウイルス研究所准教授、石井英治 同博士研究員、橋本成祐 同博士前期課程学生、秋山芳展 同教授、千葉志信 京都産業大学准教授、伊藤維昭 同シニアリサーチフェロー、小嶋誠司 名古屋大学理学研究科准教授、本間道夫 同教授らの研究グループは、海洋性ビブリオ菌は、環境中の食塩濃度変化に応じて、性質の異なる2種類のSecDFタンパク質複合体(タンパク質の膜透過装置の構成因子の一つ)を使い分けることで、タンパク質の膜透過活性を維持する巧みな機構を持つことを明らかにしました。この調節に関わる因子は、腸炎ビブリオや人食いビブリオ等の病原性ビブリオ属細菌においても広く保存されていることから、これら病原性菌の宿主への感染、増殖の際にも働いている可能性が考えられます。
本研究成果は、2015年9月21日の週に米国科学アカデミー紀要の電子版に掲載されました。
研究者からのコメント
増殖速度の早い細菌にとっては、新しく合成されたタンパク質を細胞の表面や細胞外に正確に素早く運ぶことは非常に大切です。ビブリオ属細菌は、さまざまな塩環境(海水、汽水、宿主体内)中で生育しており、こうした環境変化に迅速に適応する必要があります。本研究で、ビブリオ属細菌が持つ食塩濃度変化に対する適応機構を明らかにすることが出来ました。それと同時に、分泌監視タンパク質が持つ翻訳停止の性質を利用した発現調節機構の新たな例を示すことができました。
概要
細菌は、細胞質で作られたタンパク質が効率良く生体膜を横切る為の装置(タンパク質膜透過装置)を有しています。この輸送装置の構成因子の一つである膜タンパク質複合体SecDFは、細胞質膜を挟んで形成される一価陽イオン濃度勾配を利用してタンパク質膜透過を促進しています。本研究では、海洋性ビブリオ菌が、2種類のSecDFパラログ(SecDF1, SecDF2)を持ち、前者がNa + を、後者がH + を利用している事を明らかにしました。また、ビブリオ菌は、Na + が豊富な環境ではNa + 駆動型のSecDF1のみを利用していますが、環境中のNa + 濃度が低下するなど細胞のタンパク質膜透過能が低下した際には、SecDF2を新しく合成し、膜透過装置を再編成することによりH + 濃度勾配を利用してタンパク質膜透過能を維持する巧妙な仕組みを持つ事を見いだしました。さらには、この発現上昇には、 secDF2 遺伝子の同一オペロン上流に存在する遺伝子によってコードされる分泌タンパク質VemP(Vibrio protein export monitoring polypeptide)が必須の役割を持つ事も明らかにしました。VemPは、細胞のタンパク質膜透過能を自身の膜透過能として監視し、膜透過能が低下した時にはリボソームによる自身の翻訳を停止することで、周辺のmRNAの二次構造がほどけた状態を維持し下流の secDF2 遺伝子の発現を促すと考えられます。
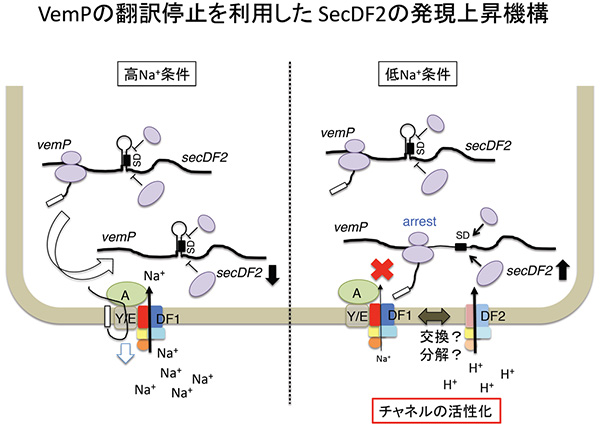
(左)高食塩環境では、Na + 濃度勾配エネルギーを利用してSecDF1が十分に機能できるため、VemPタンパク質の翻訳停止は一過的であり、SecDF2の合成は抑制される。(右)低食塩環境下では、Na + 濃度勾配の減少によりSecDF1の機能が低下し、VemPの分泌能も低下する。その結果VemPの翻訳停止状態が安定化し、mRNAの特徴的な二次構造がほどけた状態が持続する。SecD2に対するSD配列(リボソーム結合部位)が露出し、SecDF2の合成量が増加する。SecDF2はSecDF1と置き換わり、H + 濃度勾配を利用できる新しいタンパク質の膜透過装置が再構築される。
詳しい研究内容について
書誌情報
[DOI] http://dx.doi.org/10.1073/pnas.1513001112
Eiji Ishii, Shinobu Chiba, Narimasa Hashimoto, Seiji Kojima, Michio Homma, Koreaki Ito, Yoshinori Akiyama, and Hiroyuki Mori
"Nascent chain-monitored remodeling of the Sec machinery for salinity adaptation of marine bacteria"
PNAS, published ahead of print September 21, 2015





