2013年9月17日

左から竹馬助教、RUI大学院生
本庶佑(ほんじょ たすく) 医学研究科客員教授、竹馬俊介(ちくま しゅんすけ) 同助教、RUI YUXIANG 同大学院生の研究グループは、免疫のブレーキとして働く分子、PD-1を欠損したマウスを用いて、同分子が自己免疫疾患を抑制する新たな機構を明らかにしました。
この研究成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)の電子版(米国東海岸標準時9月16日)に掲載されました。
背景と目的
私たちの体にそなわった免疫系は、病原体から体を守るために必須のシステムですが、これが間違って自己を攻撃してしまうと深刻な自己免疫疾患を起こします。これら免疫疾患は、個人の遺伝的要因および衛生状態など環境要因の両方によって引き起こされます。
PD-1は、活性化リンパ球に発現するレセプターで、生体防御と自己免疫疾患の両方に必須なTリンパ球の、過剰な活性化を抑制することが知られています(図1)。マウスやヒトのPD-1不全は多発性硬化症、I型糖尿病、リウマチ、全身性エリテマトーデスといった難治性自己免疫疾患の遺伝的危険因子です。本研究グループは、PD-1欠損マウスではTリンパ球から過剰のサイトカインが産生され、自己免疫発症の第一のステップが突破されることを見出していました(Chikuma et al. J Immunol, 2009)。しかしながら、リウマチや多発性硬化症といった難病の発症には、T細胞のさらなる悪玉細胞への分化が関わっており、これには微生物などの環境因子に対して初期の炎症反応を起こす細胞群「自然免疫細胞」が産生するサイトカインが必要です(図2)。ただし、PD-1が自己免疫を抑制する一つの原因として自然免疫反応の調節を行う可能性については検討されていませんでした。
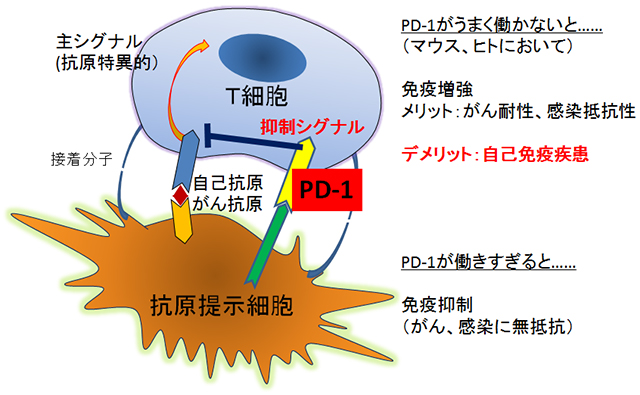
図1:PD-1は免疫の主要なブレーキとして働くレセプターである
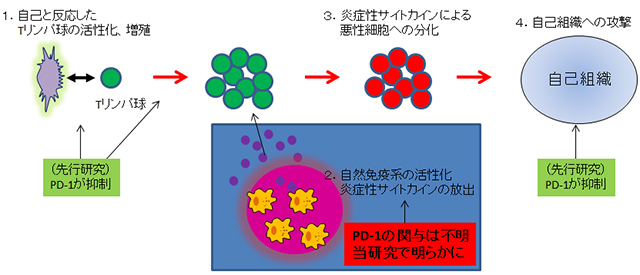
図2:Tリンパ球系自己免疫疾患の発症モデルとPD-1の関与
方法と結果
ヒト多発性硬化症のマウスモデルとして知られる、実験的脳脊髄炎(EAE)でPD-1欠損(ノックアウト:KO)マウスが症状の悪化を呈することが知られています。EAEは、マウスに自己の脳抗原を模したT細胞性抗原と、自然免疫系を活性化する、免疫賦活剤を同時投与することによって誘導されます。PD-1 KOでは、野生型コントロール(wild-type:WT)に比べ、早期の発症と重症化が観察されますが、この傾向は免疫賦活剤に含まれる結核死菌を少なくしていった場合にもっとも顕著でした。また、追跡調査によって、PD-1 KOのT細胞がEAEの悪玉細胞である、IL-17産生ヘルパーT細胞(Th17)に強く分化していることがわかりました。
Th17の分化には、T細胞の強い活性化と自然免疫系が起こす炎症が両方必要であることから、PD-1 KOではどちらもの反応が亢進しているのではないかと考えました。しかしながら、二つの反応は体内で同時におこるため、これらを別々に評価することは困難でした。そこで、Tリンパ球を遺伝的に作ることができないRAG2 KOマウスにPD-1 KOを交配し、Tリンパ球が出来ない環境で結核死菌のみを投与し、ピュアな自然免疫反応を誘導しました(第一段階)。ここから得られた自然免疫細胞を用いて、抗原特異的にTリンパ球を刺激する実験(第二段階)に用いると、刺激されたTリンパ球をTh17に強く誘導することがわかりました。第一段階にはリンパ球の関与がないため、すなわちPD-1欠損がリンパ球に関係なく、自然免疫反応を亢進する動かぬ証拠を得ました。しかも亢進した自然免疫反応は、Tリンパ球に間接的に作用して、自己免疫における悪玉Tリンパ球の分化を起こします。これを生体レベルで確認するため、PD-1をリンパ球以外の細胞でのみ欠損するマウスを作製し、EAEを誘導しました。このようなマウスでは、PD-1を持つコントロールマウスと比較して、病勢の悪化とTh17の増加が認められ、仮説が正しいことがわかりました(図3)。
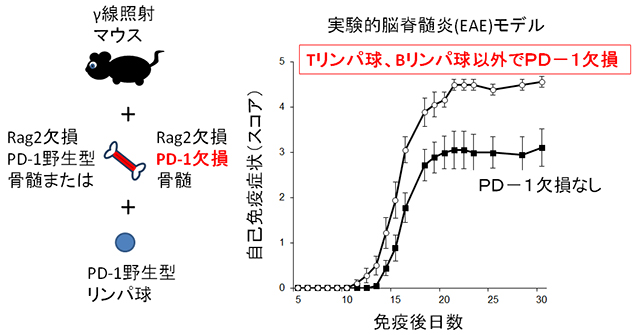
図3:鍵となる発見:PD-1は、リンパ球以外の細胞も抑制する
自然免疫細胞には、樹状細胞、マクロファージといった多くの細胞が含まれ、いずれかの自然免疫細胞が産生するサイトカイン、IL-6がT細胞に作用することがTh17を分化させます。PD-1 KO由来のマクロファージを直接結核死菌で刺激すると、WTに比較して有意に多くのIL-6産生を起こすことがわかりました。このIL-6を中和抗体で阻害すると、PD-1 KOに見られた強いTh17誘導が阻害されました。以上より、PD-1は、免疫賦活剤に含まれる結核死菌を認識したマクロファージの活性化とIL-6産生を抑制することによって、Th-17の分化と、EAEの病勢を抑制すると考えられました。
本研究の意義
PD-1による抑制はT細胞に対して直接発揮されると考えられていましたが、T細胞を作れないマウスを用いた実験系によって、T細胞の分化を間接的に支配する自然免疫系をも抑制することがわかりました(図4)。PD-1は、自己組織に対する反応だけでなく、免疫を撹乱するカビやウイルス、細菌感染などの環境因子に対する反応も良い具合に調節することで、健康を守っていることがわかります。
今後、この分子機構を明らかにしていくことが、自己免疫疾患のメカニズムをより深く理解するために重要です。
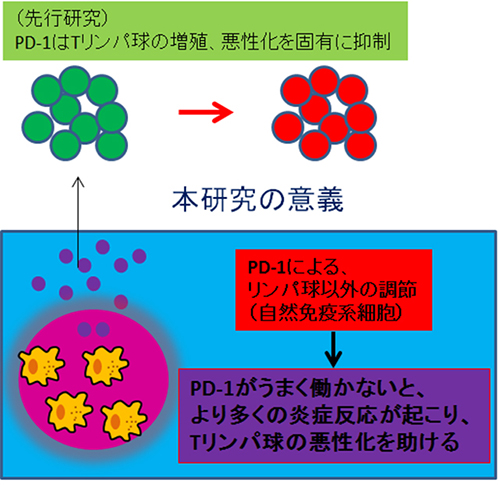
図4:新たに明らかになった点
本成果は、以下の研究費によって得られました。
- 文部科学省科学研究費補助金 若手研究(B)21790465、23790534 および基盤研究(C)25460363
研究代表者:竹馬俊介
研究期間:2009年4月~2016年3月 - 平成24年度千里ライフサイエンス財団・岸本基金研究助成
研究代表者:竹馬俊介
書誌情報
[DOI] http://dx.doi.org/10.1073/pnas.1315828110
[KURENAIアクセスURL] http://hdl.handle.net/2433/178757
Yuxiang Rui, Tasuku Honjo, and Shunsuke Chikuma.
Programmed cell death 1 inhibits inflammatory helper T-cell development through controlling the innate immune response.
Proceedings of the National Academy of Sciences of the United States of America; published ahead of print September 16, 2013.
- 京都新聞(9月17日 20面)および日刊工業新聞(9月17日 11面)に掲載されました。

