2008年10月17日
京都大学
科学技術振興機構(JST)
 |
| 左から岩田 想 医学研究科 教授、島村 達郎 科学技術振興機構 研究員 |
JST基礎研究事業の一環として、岩田 想 医学研究科 教授は、独立行政法人理化学研究所、インペリアル大学、リーズ大学との共同研究で、細胞の物質輸送に関わるヒダントイン輸送体(Mhp1)について、X線結晶構造解析に成功しました。さらにガラクトース輸送体の構造と比較することによって、細胞の物質輸送を担う輸送体一般に共通な輸送機構の分子メカニズムの一端を解明しました。
生物を構成する細胞は細胞膜によって内と外に隔てられ、生命の維持のために細胞膜を介して様々な物質のやりとりをしています。細胞膜には輸送体と呼ばれる 多種の膜たんぱく質が存在し物質の輸送を担っています。輸送機構としては、輸送路に入った物質を輸送体の中央付近にあたる部位に結合し、その部位の両端に あるゲートを交互に開閉して輸送を行うという「アルタネイティングアクセスモデル」が提唱されています。しかしながら、その分子メカニズムについてはあま り理解が進んでいませんでした。
本研究で用いたMhp1は、ミクロバクテリウム(Microbacterium liquefaciens)という細菌から分離されたもので、核酸塩基-陽イオン共輸送体ファミリーに属します。この輸送体はアミノ酸の前駆体を輸送する役割を担っていると考えられています。本研究では、細胞外からの輸送物を待ち受ける状態の構造と、取り込んだ輸送物を輸送体の中央付近に結合した状態の構造を明らかにしました。Mhp1の構造は、ヒトの神経伝達物質輸 送体、および小腸において糖の取り込みを行うナトリウム依存性グルコース輸送体と類似の構造をとっていることがわかりました。2つのヒトの輸送体の構造は やはり細菌由来の類似輸送体であるロイシン輸送体およびガラクトース輸送体の構造から推定されています。ガラクトース輸送体では、輸送体の中央付近から細 胞内に面した輸送路へ輸送物を送り出す直前の状態の構造が報告されています。これらの構造を比較検討することで、輸送体における「アルタネイティングアク セスモデル」の分子メカニズムの一端が明らかになりました。
本研究成果は、ヒトにも普遍的に存在する輸送体に共通な輸送機構の分子メカニズムについて、その一端を解明した極めて重要な成果で、ひいては輸送機構の異常がもたらす病態の解明や、それに基づく診断・創薬・治療に役立つものと期待されます。
本研究では、以下のJSTの事業・研究プロジェクトにおいて、Membrane Protein Laboratory(英国放射光施設ダイアモンドの膜たんぱく質研究室)で研究を行っている、Alexander David Cameron グループリーダー、島村 達郎 研究員やSimone Weyand 外部協力研究員らが中心となって構造解析に成功しました。米国科学誌「Science」の電子版に2008年10月16日(米国東部時間) に公開されました。
- 戦略的創造研究推進事業 ERATO型研究
研究プロジェクト : 「岩田ヒト膜受容体構造プロジェクト」
研究総括 : 岩田 想 医学研究科 教授
研究期間 : 平成17~22年度
研究の背景と経緯
細胞は生命の維持のため、外界と細胞内との間で物質の輸送を行っており、細胞膜に存在する輸送体等がその輸送に大きく関与しています。輸送体はエネルギー を必要とする能動輸送体と、エネルギーを必要としない受動輸送体に分けられます。能動輸送体には、光などのエネルギーを用いて物質を輸送する一次性能動輸 送体や、一次性能動輸送により蓄積されたエネルギーを用いて物質を輸送する二次性能動輸送体があります。二次性能動輸送体は、共役するイオンと物質の輸送 の方向に基づいて共輸送体や逆輸送体等に分類されています。
これらの各種輸送体に共通な輸送機構として、「アルタネイティングアクセスモデル」が提唱されています。このモデルでは、輸送体の中心に輸送物(基質)の 結合する位置があり、細胞外と細胞内をつなぐ輸送路の両側にゲートが存在します。2つのゲートが交互に開閉することにより、基質の輸送を行うと考えられて います。輸送体は細胞において普遍的に存在する極めて重要な膜たんぱく質であり、輸送体の立体構造の解析、およびその結果に基づいた分子レベルでの輸送機 構の解明が期待されています。一部の一次性能動輸送体では、様々な構造解析の結果に基づいて輸送機構の研究が進んでいます。一方、二次性能動輸送体では、ラクトース透過酵素や その類縁体で生化学的・構造生物学的な研究が行われていますが、分子メカニズムに関する理解は進んでいません。輸送体はその他の膜たんぱく質と同様に疎水 性の高い脂質二重膜に埋もれているので疎水性に富んでおり、そのために結晶化が難しく、立体構造の解明を阻んでいることがその理由にあげられます。
本研究で用いたヒダントイン輸送体(Mhp1)は、ミクロバクテリウム(Microbacterium liquefaciens)という細菌から分離され、アミノ酸の前駆体であるベンジルヒダントイン等の取り込みを媒介すると考えられています。Mhp1 は、核酸塩基やその関連化合物の再生経路に必須である、核酸塩基-陽イオン共輸送体ファミリー(NCS1ファミリー)に属し、細菌、古細菌、真菌や植物に 広く分布しています。本研究では、二次性能動輸送体の分子メカニズムを解明するために、この輸送体の構造解析に取り組みました。その構造を解いてみると、 Mhpは神経伝達物質ナトリウム共輸送体ファミリー(NSSファミリー)のロイシン輸送体(LeuTAa)や溶質ナトリウム共輸送体ファミリー(SSS ファミリー)に属するガラクトース輸送体(vSGLT)と類似の構造であることが明らかになり、輸送体一般に共通な輸送機構の分子メカニズムの一端を解明 することが可能となりました。
研究成果の概要
- 構造決定
基質の結合していないMhp1は、2.85オングストロームの解像度で構造解析されました。基質であるベンジルヒダントインと結合したMhp1の構造は、 4オングストロームの解像度でしたが、明瞭に基質の結合の位置やその近傍の構造変化を観察することができました。 - 基質の結合していない構造
輸送体は12本の膜貫通へリックス(らせん構造をとったペプチド鎖)で外向きキャビティー(空洞)を有していました(図1)。N末端の5本のヘリックス (TM1~5)と次の5本のヘリックス(TM6~10)の2つの領域が対向する形をとっていました。2つの繰り返し領域は絡み合っており、4本のヘリック ス(TM1、TM2、TM6、TM7)が束となって中心となる核を形成し、その周囲を残りの6本のヘリックスから成る層が囲んでいました(図1A~C)。 図1B、1Cでは、推定された基質が結合する位置を示すために、外向きキャビティーの底にベンジルヒダントインを示してあります。2本のヘリックス (TM11、TM12)およびC末端部分の機能は不明です。Mhp1の特徴的な対向する2つの領域は、1次配列上の類似性が低いLeuTAaやvSGLT の構造と類似していました(図2)。 - 基質の結合した構造
Mhp1と基質との複合体の構造では、LeuTAaにおけるロイシンの結合部位やvSGLTにおけるガラクトースの結合部位の近傍に相当する位置に、ベン ジルヒダントインが確認されました(図2)。外向きキャビティーは、ヘリックスTM10が途中から折れ曲がることにより、外側のゲートが閉じた構造となっ ていました。これは、基質が細胞外に戻らないように、また不用な物質が細胞内に入らないようにする仕組みと考えられます。 - 陽イオンの結合部位
基質の結合していない構造では、基質結合部位の近傍でヘリックスTM1が折れ曲がった部分に、ナトリウムの結合している陽イオン結合部位が見いだされました。興味深いことに、陽イオン結合部位には酸性残基は存在せず、ヘリックスの双極子モーメントの効果によって、この結合部位が形成されていると考えられます。 - 基質の輸送機構
「アルタネイティングアクセスモデル」には、図3に示したように、4つの主な状態が存在します。(1)基質を待ち受ける「外向きで開いた状態」、()基質 を取り込んで「外向きで閉じた状態」、(3)基質を放出する前の「内向きで閉じた状態」、(4)基質を放出した「内向きで開いた状態」です。(1)は Mhp1の基質の結合していない構造に、(2)はMhp1の基質の結合した構造に、(3)はvSGLTで報告された構造に対応しています。本研究と vSGLTの構造と比較することにより、膜の外側からの取り込み、膜の外側から内側への運搬の様子が明らかになりました。図3に模式化したように、細胞外 側や内側に面した輸送路、基質結合サイトの両端のゲートの開閉は、ヘリックスの動きに制御され、大きな構造変化を伴った巧妙な仕組みで物質が運搬されま す。
参考図
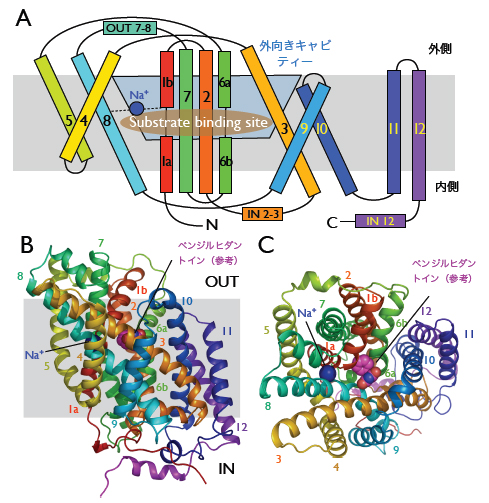
Mhp の立体構造 (A)Mhpの膜貫通ヘリックスのトポロジーと基質およびナトリウムイオンの結合部位を示した模式図。観測された外向きキャビティーの位置も示し た。(B)Mhpの構造を膜に平行な方向から示したもの。(C)Mhp1の構造を膜の外側から示したもの。(B)と(C)ともにたんぱく質部分は基質が結 合していない構造をもとにしているが、参考のために基質の結合する位置を示した。
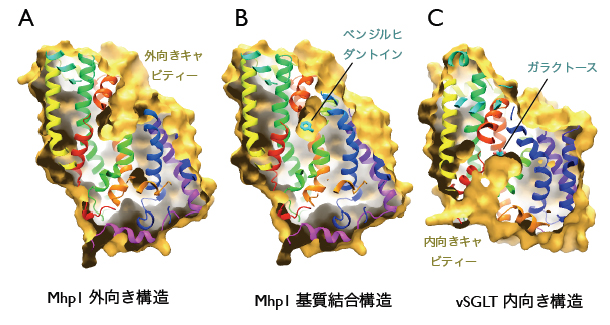
外向きと内向きのキャビティー。(A)Mph1の基質なしの構造。外向きキャビティーが開いている。(B)基質結合時のMhp1の構造。外向きキャビティーが閉じている。(C)vSGLTの構造。内向きキャビティーが開いている。
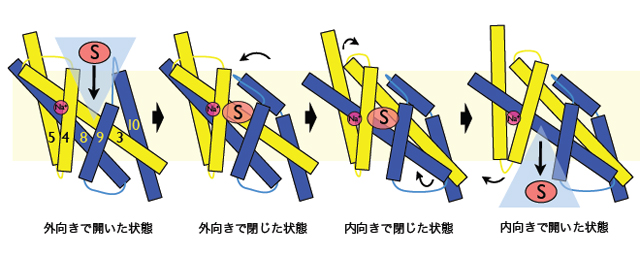
推定されるMph1の基質輸送機構。Sは基質を、Na+はナトリウムイオンを表している。
今後の展開
近年の輸送体のX線結晶構造解析の結果は、輸送機構の分子メカニズムの解明に画期的な進歩をもたらしました。本研究で得られた構造に加え、さらにMhp1 の「内向きで閉じた状態」と「内向きで開いた状態」の構造の解析などを通じて、より詳細な輸送体の分子メカニズムを解明したいと考えています。また、その 他の多くの輸送体の構造解析を実施し、輸送体が関わる生理機能、役割、またその異常による病態の解明に寄与することを目指します。
掲載論文名
"Structure and molecular mechanism of a nucleobase-cation-symport-1 family transporter"
(核酸塩基—陽イオン-共輸送-1ファミリー輸送体の構造と分子メカニズム)
- 京都新聞(10月17日 29面)、日刊工業新聞(10月17日 25面)および読売新聞(10月17日 2面)掲載されました。

