2008年4月3日

左から生命科学研究科の松田道行教授、北野正寛大学院生、中村岳史講師
松田道行生命科学研究科教授(高次生命科学専攻)らの研究グループは、細胞の食胞機能を制御するRab5蛋白質の活性を生細胞で観察できるバイオセンサーを開発し、死んだ細胞が貪食される過程でのRab5蛋白質の活性変化をビデオ画像化することに世界で初めて成功し、その論文が英国科学誌「Nature」誌に掲載されることになりました。
なお、この研究成果は2日付英科学誌「Nature」誌のオンライン版に掲載されます。
京都大学大学院生命科学研究科 北野正寛、中村岳史、松田道行
研究成果の概要
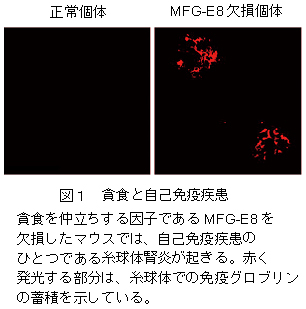
からだの中では、不要になった細胞や癌細胞には細胞死が誘導され、それらはマクロファージなどの細胞によって貪食される。貪食された死細胞は、細胞内の食胞という袋状の場所に封じ込められる。この食胞は分解酵素を持つリソソームと融合し、その働きにより取り込んだ死細胞を消化する。貪食作用がうまく働かなくなると、死んだ細胞から中身が無秩序に漏れ出して自己免疫病を起こしたり(図1)、癌細胞に対する正常な免疫反応が起きなかったりする。
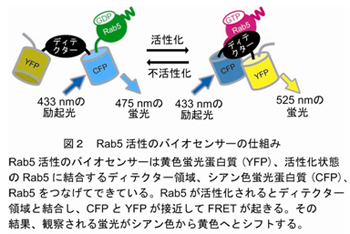
生命科学研究科生体制御学分野(松田道行教授、中村岳史講師)では、医学研究科医化学教室(長田重一教授)と共同で、食胞の機能を制御するRab5蛋白質の活性を生細胞で観察できるバイオセンサーを開発し(図2)、死んだ細胞が貪食される過程でのRab5蛋白質の活性変化をビデオ画像化することに世界で初めて成功した。
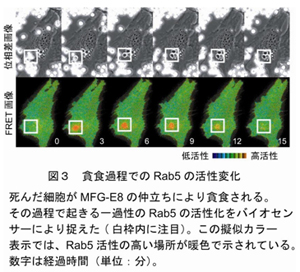
からだの中の死細胞は長田教授らが発見したMFG-E8という分子の働きにより、貪食細胞に取り込まれ、食胞を形成し、やがて消化される。この過程での Rab5蛋白質の活性をビデオ画像化してみると、Rab5蛋白質の活性は食胞を包んでいた繊維状皮膜の消失と同時に上昇し、約10分間持続して貪食された細胞が崩壊する前に消失した(図3)。
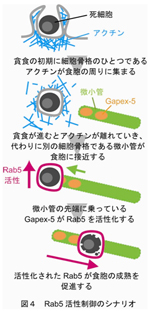
また、Rab5蛋白質の活性化を起きなくすると貪食された死細胞の消化が遅れることから、取り込んだ物質の分解に必要な「食胞の成熟」に、Rab5蛋白質が関与することがわかった。さらに、この食胞上でのRab5蛋白質の活性化は微小管の先端に結合するGapex-5という蛋白質が担っていることも発見した。これにより図4のようなRab5活性制御のシナリオが初めて明らかになった。
この研究は、感染症や癌などの病気から体を守る重要な生理機能である貪食作用のメカニズムの一端を明らかにするものである。また今回作製されたRab5活性のバイオセンサーは、今後薬剤の高効率スクリーニング系の開発につながると期待される。
- 京都新聞(4月3日 28面)及び日本経済新聞(4月3日 34面)に掲載されました。

