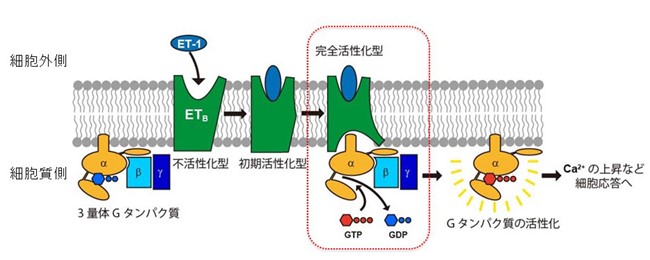
ヒトは約60兆個の細胞で構成されており、細胞間での情報交換が協調的に行われることで、正常な生命活動を維持しています。各細胞は細胞膜に包まれ、細胞外からのさまざまなシグナルは、細胞膜の受容体タンパク質によって細胞内に伝えられます。血管収縮作用を持つペプチドホルモンであるエンドセリン(ET)については、細胞膜に存在するエンドセリンB型受容体(ETBR)との結合構造が解明されていますが、ETBRとGタンパク質(細胞膜上で情報伝達を担うタンパク質)の天然結合状態の複合体構造は未解明であり、情報伝達メカニズムも十分に理解されていません。
土井知子 理学研究科准教授(研究当時)、谷一寿 筑波大学教授、ブルーノ・ホンベル 沖縄科学技術大学院大学博士、寺田透 東京大学教授、米倉功治 理化学研究所グループディレクター(兼:東北大学教授)らの研究グループは、クライオ電子顕微鏡を用いて、ET、ETBR、Gタンパク質の複合体構造を観察しました。その結果、Gタンパク質とETBRが強く結合する構造が明らかになりました。また、Gタンパク質の種類を識別するメカニズムや、受容体の活性化に関わる要因を解明しました。
本研究は、ETによる細胞情報伝達メカニズムの理解を深めるだけでなく、立体構造に基づいた新しい薬剤設計に役立つと期待されます。
本研究成果は、2024年10月16日に、国際学術誌「Communications Biology」にオンライン掲載されました。
【DOI】
https://doi.org/10.1038/s42003-024-06905-z
【KURENAIアクセスURL】
http://hdl.handle.net/2433/290605
【書誌情報】
Kazutoshi Tani, Saori Maki-Yonekura, Ryo Kanno, Tatsuki Negami, Tasuku Hamaguchi, Malgorzata Hall, Akira Mizoguchi, Bruno M. Humbel, Tohru Terada, Koji Yonekura, Tomoko Doi (2024). Structure of endothelin ETB receptor–Gi complex in a conformation stabilized by unique NPxxL motif. Communications Biology, 7, 1303.





