茶竹俊行 複合原子力科学研究所准教授、千葉薫 茨城工業高等専門学校教授、松井拓郎 元日本原子力研究所(現:日本原子力研究開発機構)特別研究員、大原高志 日本原子力研究開発機構研究主幹、故・油谷克英 理化学研究所上級研究員、田中伊知朗 茨城大学教授、新村信雄 元日本原子力研究所研究主幹・元茨城大学教授は、日本原子力研究所の生体高分子用単結晶中性子回折装置-3(BIX-3)を用いて、ヒトリゾチーム(130アミノ酸からなる分子量14.3kDaのタンパク質分子)の中性子結晶構造解析実験を行ないました。
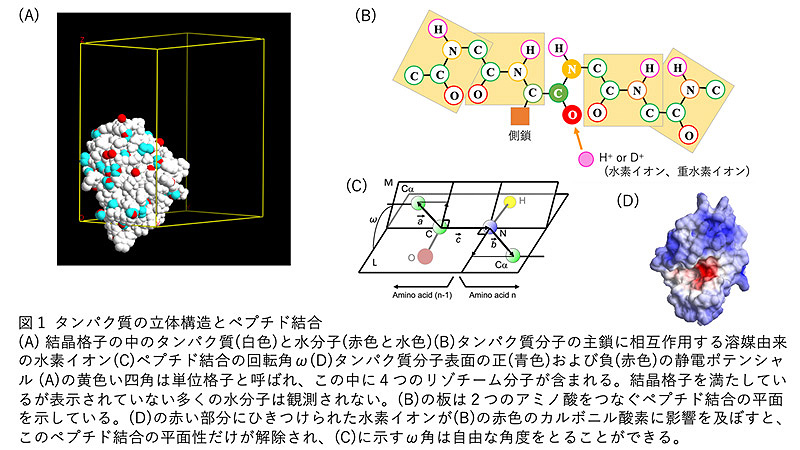
タンパク質はアミノ酸が1本の鎖状につながった巨大分子です。これまで、タンパク質分子の骨格である主鎖を支えるペプチド結合は、Paulingらが調べた小さな有機化合物の中のペプチド結合と同じく、1951年以降現在まで、一様な硬さの平面構造をとると考えられてきました。プロテインデータバンク(PDB)に登録された20万個以上のタンパク質分子の立体構造解析も、原則的にはペプチド結合が平面であるという前提で行われています。しかし、本研究で行なったヒトリゾチームの中性子結晶構造解析を起点として、複数の実験手法で得られたデータを精査したところ、タンパク質の分子の中では、タンパク質分子自身が作る静電ポテンシャルなどにより作られる「タンパク質場」に引き寄せられた水素イオンまたは重水素イオンによって、ペプチド結合が個々に柔らかくなることがわかりました。本研究の結果は、タンパク質のペプチド結合は一様に硬い平面である、という、長年にわたりタンパク質の構造研究を支えてきた概念と、タンパク質の主鎖は立体構造の骨格を保ち、側鎖が機能を担う、という役割分担を見直す必要があることを示しています。
本研究成果は、2023年9月20日に、国際学術誌「Protein Science」にオンライン掲載されました。
「中性子結晶構造解析は水素を観測できる有用な実験方法です。これまでのタンパク質中性子結晶構造解析では、結晶構造解析で観測しにくい動きやすい側鎖の水素に着目した研究が主流でした。本研究では、研究対象を動きにくい主鎖に絞り、NMRなど、結晶構造解析以外の手法を、その測定原理に遡って組み合わせて用いることにしました。その結果、全てのタンパク質で利用できる、タンパク質の主鎖が実は持っていた知られざる機能を見出すことができました。今後は、ペプチド結合が柔らかくなるという現象が、生命活動の中でどのように利用されているかを探究するとともに、この原理を生かしたタンパク質分子デザインの実現にチャレンジしていきたいと考えています。」
【DOI】
https://doi.org/10.1002/pro.4765
【書誌情報】
Kaori Chiba, Takuro Matsui, Toshiyuki Chatake, Takashi Ohhara, Ichiro Tanaka, Katsuhide Yutani, Nobuo Niimura (2023). Site-specific relaxation of peptide bond planarity induced by electrically attracted proton/deuteron observed by neutron crystallography. Protein Science, 32(10):e4765.





