岩田想 医学研究科教授(兼:理化学研究所グループディレクター)、南後恵理子 理化学研究所チームリーダー(兼:東北大学教授)、登野健介 高輝度光科学研究センターチームリーダーらの共同研究グループは、ビフィズス菌の解糖系酵素の立体構造を常温下で決定し、その酵素の反応メカニズムに関する新たな知見を見いだしました。
本研究成果は、生理的環境下に近いタンパク質構造を取得することで、酵素反応メカニズムの解明に有用な情報が増える可能性を示しており、各種酵素の高機能化設計などを通して、酵素の産業利用の高度化に貢献すると期待できます。
今回、本研究グループは、X線自由電子レーザー(XFEL)施設「SACLA」において連続フェムト秒結晶構造解析(SFX)法により、ビフィズス菌の解糖系酵素の一つであるホスホケトラーゼの常温構造解析に成功しました。その結果、ホスホケトラーゼの活性部位の入り口に位置する小さなループ状構造が、従来の極低温構造とは異なっていることを発見しました。同時に実施した阻害剤との複合体構造の特徴も踏まえた考察により、ホスホケトラーゼの反応メカニズムに関する新たな知見を得ることができました。解析に必要なホスホケトラーゼの微小結晶は光誘起タンパク質結晶化プレートを用いて取得し、この結晶化法がSACLAでの構造解析の効率化に有効であることも分かりました。
本研究は、SACLA産学連携プログラムにて行われました。
本研究成果は、2023年3月28日に、国際学術誌「Acta Crystallographica Section D」にオンライン掲載されました。
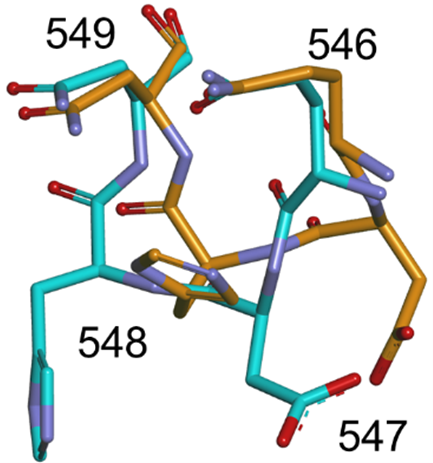
(常温構造はオレンジ色、極低温構造は水色で示す)
【DOI】
https://doi.org/10.1107/S2059798323001638
【書誌情報】
Kunio Nakata, Tatsuki Kashiwagi, Naoki Kunishima, Hisashi Naitow, Yoshinori Matsuura, Hiroshi Miyano, Toshimi Mizukoshi, Kensuke Tono, Makina Yabashi, Eriko Nango, So Iwata (2023). Ambient temperature structure of phosphoketolase from Bifidobacterium longum determined by serial femtosecond X-ray crystallography. Acta Crystallographica Section D Structural Biology, 79(4), 290-303.





