ターゲット
公開日
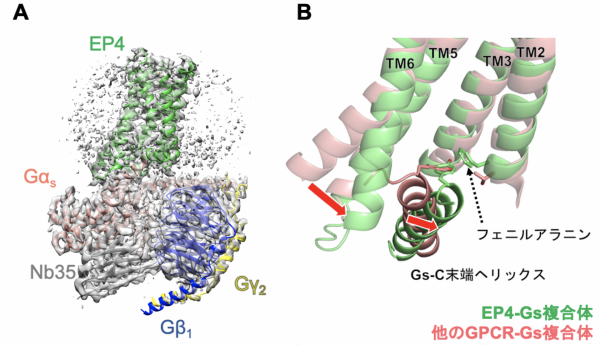
岩田想 医学研究科教授、野島慎五 同博士課程学生、野田岳志 ウイルス・再生医科学研究所教授、藤田陽子 同博士課程学生、 清水(小林)拓也 関西医科大学教授、山本雅貴 理化学研究所部門長、重松秀樹 同研究員らの研究グループは、プロスタグランジン(以下「PGE2」)が結合したプロスタグランジン受容体(以下「EP4」)と、Gタンパク質の複合体を精製・解析し、世界で初めてその構造と活性化メカニズムを解明しました。
また、EP4は同じGsタンパク質共役受容体グループの中の他の受容体では見られなかった特徴的な結合状態を有しており、プロスタグランジン受容体に特有の結合方法であることが予想されます。EP4作動薬は潰瘍性大腸炎や急性心不全などの治療薬として期待されており、今回EP4の活性化メカニズムが解明されたことから、これらの病気を治す新たな治療法開発の可能性が広がりました。
本研究成果は、2020年12月2日に、国際学術誌「Structure」に掲載されました。
研究者情報
研究者名
岩田想
研究者名
野田岳志
書誌情報
【DOI】https://doi.org/10.1016/j.str.2020.11.007
Shingo Nojima, Yoko Fujita, Kanako Terakado Kimura, Norimichi Nomura, Ryoji Suno, Kazushi Morimoto, Masaki Yamamoto, Takeshi Noda, SoIwata, Hideki Shigematsu, Takuya Kobayashi (2020). Cryo-EM Structure of the Prostaglandin E Receptor EP4 Coupled to G Protein. Structure.





