坂本智子 iPS細胞研究所特定研究員、タムケオ・ディーン 医学研究科特定准教授、成宮周 名誉教授(医学研究科特任教授)らの研究グループは、精巣内のセルトリ細胞表層にある細胞骨格アクチンの網目状構造によって、正常な精子の形態が形成される分子メカニズムを解明しました。
本研究成果は、2018年9月26日に米国の国際学術雑誌「PLOS Biology」のオンライン版に掲載されました。
研究者からのコメント
近年、少子化が社会的な問題になっており、不妊の診断及び治療が喫緊の課題です。これまでの研究により、不妊の約半分は男性不妊であることが明らかになりましたが、その多くは原因がまだ不明のままです。本研究によって明らかになったセルトリ細胞におけるmDia1/3機能の知見は、今後の男性不妊の診断及び治療開発に応用されることが期待されます。
概要
不妊の原因の約半数を占める男性不妊の原因の多くは精子形成障害ですが、その原因が不明なため、根本的な治療法はないのが現状です。しかし、正常な精子の形成には、精子細胞と、精巣内に存在する支持細胞であるセルトリ細胞との密接な相互作用が重要であることが分かっていました。
本研究グループは、この精子細胞とセルトリ細胞の細胞間接着を強化する細胞骨格アクチンの構造が、アクチンの重合を促進するmDia1およびmDia3タンパクによって作られ、正常な精子の形態形成に寄与していることを見出しました。このmDia1およびmDia3を二つとも欠損すると、精子細胞とセルトリ細胞の接着形成・維持に障害をきたし、精子の形成不全が起きることも確認しました。
本研究成果は、セルトリ細胞内のアクチン細胞骨格系の異常が男性不妊の原因の一つとなることを示唆するものであり、新しい男性不妊の治療法の開発につながる可能性を提示するものです。
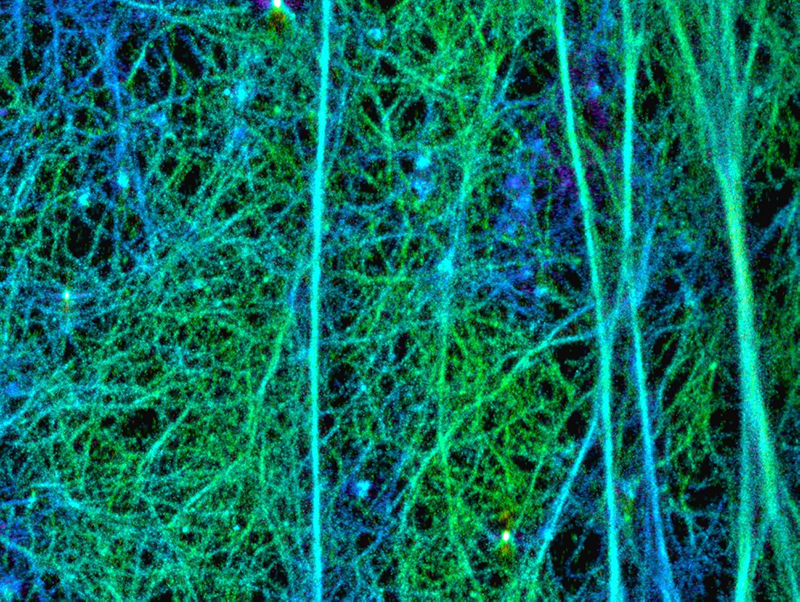
図:セルトリ細胞皮質下アクチン繊維構造の超解像度イメージング
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1371/journal.pbio.2004874
【KURENAIアクセスURL】 http://hdl.handle.net/2433/234707
Satoko Sakamoto, Dean Thumkeo, Hiroshi Ohta, Zhen Zhang, Shuangru Huang, Pakorn Kanchanawong, Takayoshi Fuu, Sadanori Watanabe, Kentaro Shimada, Yoshitaka Fujihara, Shosei Yoshida, Masahito Ikawa, Naoki Watanabe, Mitinori Saitou, Shuh Narumiya (2018). mDia1/3 generate cortical F-actin meshwork in Sertoli cells that is continuous with contractile F-actin bundles and indispensable for spermatogenesis and male fertility. PLOS Biology, 16(9):e2004874.
- 京都新聞(10月12日 29面)および毎日新聞(10月16日 26面)に掲載されました。





