老木紗予子 農学研究科博士課程学生、橋本渉 同教授、村田幸作 摂南大学教授らの研究グループは、鼠咬症の起因菌であるグラム陰性連鎖桿菌(齧歯類の口腔内に常在し、齧歯類に咬まれると、発熱や頭痛を引き起こす細菌)の細胞表層に局在する基質結合タンパク質が、動物の細胞外マトリックス成分であるコンドロイチン硫酸に対して、その硫酸基の数により結合の仕組みを変化させることを見出しました。
本研究成果は、2017年12月5日午後7時に英国の科学誌「Scientific Reports」に掲載されました。
研究者からのコメント
硫酸基のような小さな原子団が巨大分子であるタンパク質の構造を変化させるメカニズムを明らかにすることにより、標的タンパク質に結合する化合物(例:感染症治療薬)の部分的改変が、標的タンパク質の機能を制御することに繫がると期待されます。
概要
ある種の細菌は、動物に共生または感染する際、動物の細胞外マトリックスを標的とします。動物細胞の外側を覆う(細胞外)マトリックスの主要成分として、グリコサミノグリカン(GAG)が存在します。典型的なGAGとして、ウロン酸とアミノ糖の二糖の反復配列からなるヒアルロン酸、コンドロイチン硫酸、ヘパリン、ヘパラン硫酸などがあげられます。またGAGは、軟骨成分としても知られています。細菌は、これらのGAGを増殖のための栄養素、および/あるいは動物細胞に定着するための足場として利用します。
細菌がGAGを栄養素として利用する場合、GAGを細菌細胞内に取り込む必要があります。最近、本研究グループは、病原細菌である連鎖桿菌が動物細胞のGAG(コンドロイチン硫酸)を取り込む分子メカニズムの一端を初めて明らかにしました。本菌は、断片化したコンドロイチン硫酸(二糖)を、細胞表層の基質結合タンパク質による結合と解離を介して、ATP結合カセット(ABC)トランスポーターにより細胞質内に取り込みます。しかし、コンドロイチン硫酸はその分子内に複数(0~3個/二糖単位)の硫酸基を含み、輸送タンパク質がどのように硫酸基の数を見分けるかはわかっていませんでした。
本研究では、硫酸基が二つ存在するコンドロイチン硫酸二糖(Cデルタ4S6S)に対して、連鎖桿菌の輸送タンパク質がどのように機能するかを調べました。連鎖桿菌の細胞表層に存在する断片化GAG結合タンパク質は弱いながらもCデルタ4S6Sと結合し、ABCトランスポーターの活性も少し惹起することがわかりました。これまでに、結合タンパク質が、硫酸基がないコンドロイチン二糖(Cデルタ0S)、次いで硫酸基が一つしかないコンドロイチン硫酸二糖(Cデルタ4SとCデルタ6S)と良好に結合することを明らかにし、それらの結合体の立体構造を決定しています。つまり、Cデルタ4S6Sは、連鎖桿菌にとってあまり良い栄養素ではないと考えられます。
そこで、断片化GAG結合タンパク質とCデルタ4S6Sとの結合体の立体構造を決定し、その結合様式を明らかにしました。本タンパク質は、基質であるGAG二糖と、結合または解離に伴ってドメイン構造を閉じたり、開いたりします。今回の結合タンパク質とCデルタ4S6Sとの結合体では、非結合体との構造比較により算出されるドメイン開閉度に大きな違いが見られました。Cデルタ0S、Cデルタ4SとCデルタ6Sとの結合体ではドメイン開閉度が47˚であったのに対し、硫酸基が二つあると、結合タンパク質は39˚のドメイン開閉度を示しました。つまり、硫酸基という小さな原子団が巨大なタンパク質の構造を変化させることがわかりました。基質の部分的な構造の相違が、ABCトランスポーターと連携する基質結合タンパク質のドメイン開閉度を変化させることは初めての知見です。
以上のことから、硫酸基の数によりドメイン開閉度を変化させる細菌由来基質結合タンパク質の存在を明らかにしました。
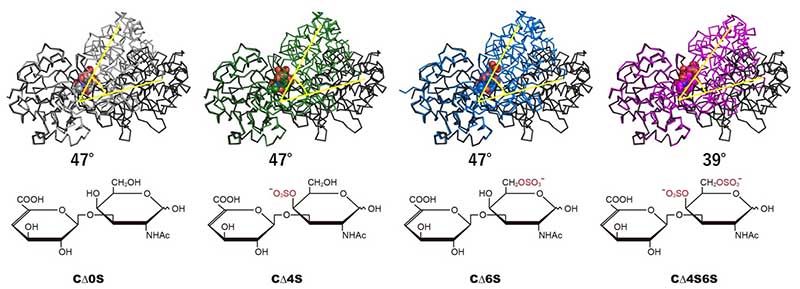
図:断片化GAG結合タンパク質のドメイン開閉度(上)とコンドロイチン二糖(下)
基質非結合体(黒)、Cデルタ0S結合体(灰)、Cデルタ4S結合体(緑)、Cデルタ6S結合体(青)、Cデルタ4S6S結合体(桃)、分子中央の球モデル:結合しているコンドロイチン二糖
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1038/s41598-017-16801-8
【KURENAIアクセスURL】 http://hdl.handle.net/2433/228204
Sayoko Oiki, Reiko Kamochi, Bunzo Mikami, Kousaku Murata & Wataru Hashimoto (2017). Alternative substrate-bound conformation of bacterial solute-binding protein involved in the import of mammalian host glycosaminoglycans. Scientific Reports, 7, 17005.





