申惠媛 薬学研究科准教授らの研究グループは、リン脂質ホスファチジルセリン(以下、PS)を細胞膜の内側へとどめているタンパク質、PSフリッパーゼの一つであるATP11Cが、細胞内Ca2+濃度の上昇(Ca2+シグナル)によって細胞膜から細胞内に取り込まれ細胞膜から隔離されることで、細胞膜の内側へPSを輸送する働きが抑えられることを発見しました。加えて、ATP11CがCa2+シグナルによってリン酸化され細胞内へ取り込まれる際の分子メカニズムも明らかにしました。このメカニズムの元となる細胞内Ca2+濃度の上昇は、Gタンパク質共役型受容体(以下、GPCR)という、創薬ターゲットとしても注目されるタンパク質群が活性化することで伝達されます。
本研究成果は、2017年11月10日午後7時に英国の科学誌「Nature Communications」に掲載されました。
研究者からのコメント
現在用いられている薬剤の半数はGPCRを直接・間接的に標的としていると言われています。今後うつ病やアレルギーに限らず幅広い治療薬の開発において、ATP11Cの不活性化メカニズムが新たなターゲットとなることが期待されます。
概要
細胞膜は2層のリン脂質膜で構成されています。リン脂質のうちPSはサプリメントとしても販売されている物質で、ストレスや運動後のダメージを軽減させる可能性が報告されています。また、記憶や認知機能とも関連があると指摘されています。細胞が生きた状態では、ほぼすべてのPSは細胞膜の内側に存在しており、細胞が死んだ場合表面へ移動し、細胞の除去や血液凝固に使われます。PSを細胞膜の内側へとどめているのはフリッパーゼというタンパク質です。フリッパーゼは文字通り、PSを細胞膜脂質二重層の外側から内側へフリップする役割を果たします。フリッパーゼの働きが妨げられることで、PSが細胞膜の表へ出てくるのですが、まだ生きている細胞でもPSが細胞表面へ出てくる場合があります。死んで除去される細胞ではなく、生きた細胞でどのようにこの現象が起こるのか、その分子メカニズムは全く分かっていませんでした。
本研究グループは、GPCRの中でも血管収縮、生体リズム、うつ病などの感情情報を制御するセロトニン受容体、花粉症などのアレルギーに関わるヒスタミン受容体の2種を対象としました。これらの活性化に伴い発信されるCa2+シグナルに応答し、ATP11Cが細胞膜から隔離されることを確認しました。また、シグナルがなくなるとATP11Cは再び細胞膜へ現れることも分かりました。すなわち、セロトニン受容体やヒスタミン受容体を介したシグナルの下流で、ATP11Cのリン脂質フリッパーゼ活性が調節されていることを初めて明らかにしました。
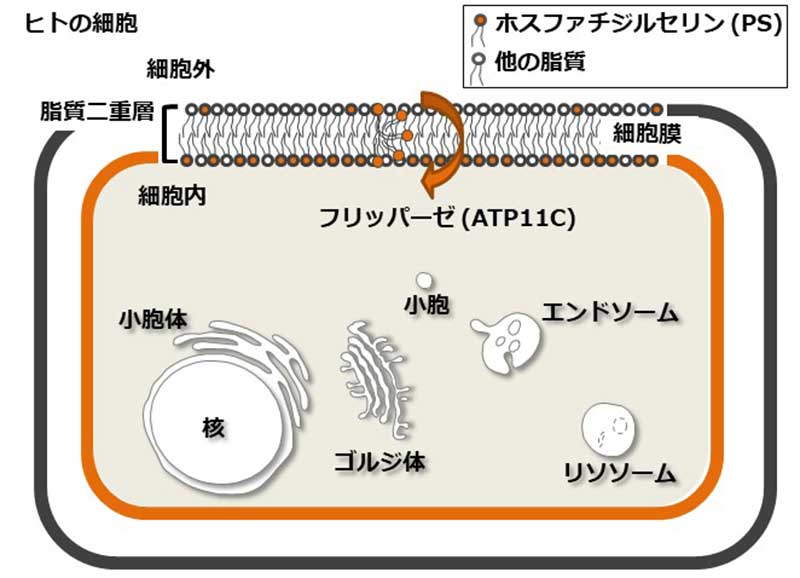
図:脂質フリップによる細胞膜脂質二重層の非対称性の調節
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1038/s41467-017-01338-1
【KURENAIアクセスURL】 http://hdl.handle.net/2433/227907
Hiroyuki Takatsu, Masahiro Takayama, Tomoki Naito, Naoto Takada, Kazuya Tsumagari, Yasushi Ishihama, Kazuhisa Nakayama & Hye-Won Shin (2017). Phospholipid flippase ATP11C is endocytosed and downregulated following Ca2+-mediated protein kinase C activation. Nature Communications, 8, 1423.





