中川一路 医学研究科教授らの研究グループは、細胞内に侵入した病原細菌や不要になったミトコンドリアをオートファジー(自食作用)が識別して分解する仕組みを明らかにしました。病原細菌による感染症にとどまらず、パーキンソン病などの神経変性疾患、癌などの発症メカニズムを理解するための重要な一歩と言えます。
本研究成果は、2017年8月26日に欧州科学誌「The EMBO Journal」でオンライン公開されました。
研究者からのコメント
オートファジーは、細胞内に蓄積した不要物が引き金となる様々な疾患を抑制していることから、本研究の成果はオートファジーを標的としたこれらの予防治療の開発に役立つと考えられます。また、細菌感染症では、これまで明らかとなってなかった細菌という異物を排除するメカニズムの一端を明らかとしたことで、新たな感染症治療法への応用が期待できます。今後は、さらにこの研究を発展させ、細菌種による認識の違いや制御メカニズムの違いを解明していきたいと考えています。
概要
オートファジー(自食作用)とは、細胞の中をオートファゴソームという膜で包み込み、その内容物を分解・再利用するシステムで細胞の恒常性維持に重要な役割を担っています。さらに、細胞内に侵入した病原細菌や、不要になったミトコンドリアといった細胞内小器官も選択的に分解します。このオートファジーにより分解される対象は、ユビキチンと呼ばれるタンパク質が目印として付けられ、そこにオートファジー受容体が結合することで選択的にオートファゴソームに包み込まれますが、オートファジー受容体がどのような仕組みで目的の不要物を識別し、結合するのかは不明でした。
本研究グループは、オートファジーが細胞内の小胞輸送システムの一つであることから、小胞輸送のスイッチの役割をもつRab GTPaseファミリータンパク質に着目しました。まず、Rab GTPaseの機能を抑える働きを持つTBC/RabGAPファミリータンパク質が過剰に発現している細胞を用いてスクリーニングを行い、オートファジー制御に関わるTBC/RabGAPとしてTBC1D10Aを同定しました。次にTBC1D10Aの基質となるRab GTPaseを働かないよう操作した細胞を用いて、オートファジーにおける機能を解析しました。
その結果、細菌が細胞内部へ侵入する際に利用するエンドソームの膜やミトコンドリア膜に存在する、Rab35と呼ばれるタンパク質がオートファジー受容体を呼び寄せることで、不要物をオートファゴソームへ包み込みませ、不要物の分解を促進していることが明らかになりました。
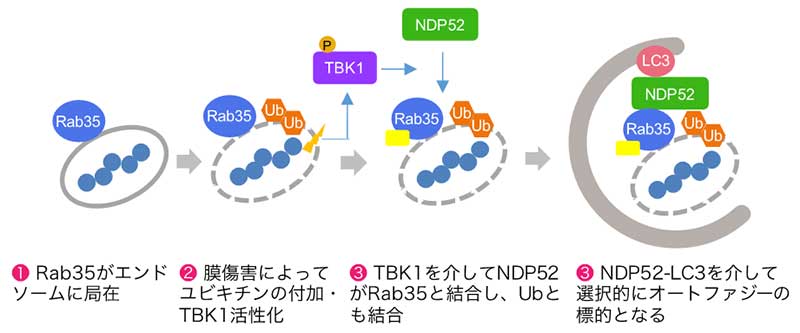
図:Rab35の役割のモデル
Rab35はエンドソームやミトコンドリアに存在し、キナーゼTBK1によって活性化したNDP52(オートファジー受容体の一つ)を呼び寄せ、NDP52とユビキチンの結合を促進する。その結果分解標的を包むようにオートファゴソームの形成が促進される。
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.15252/embj.201796463
Atsuko Minowa‐Nozawa, Takashi Nozawa, Keiko Okamoto‐Furuta, Haruyasu Kohda, Ichiro Nakagawa(2017). Rab35 GTPase recruits NPD52 to autophagy targets. The EMBO Journal, 36(18), 2790-2807.





