岩田想 医学研究科教授、濱崎直孝 長崎国際大学薬学部客員教授らは、ヒトの赤血球における酸素の輸送に重要な役割を担っている「band3(バンド3)」という膜たんぱく質の立体構造を原子レベルで解析することに成功しました。
本研究成果は、2015年11月6日(米国時間)に米国科学誌「Science」誌のオンライン版で公開されました。
研究者からのコメント

このような詳細な立体構造の情報を基に、赤血球の酸素や二酸化炭素の運搬機構や遺伝性の血液疾患の解明がさらに進み、将来、バンド3の機能を制御するための薬剤の分子設計や人工血液の開発などにもつながることが期待されます。
本研究成果のポイント
- 抗体を用いる独自の結晶化技術により、ヒトの赤血球において酸素および二酸化炭素の輸送にかかわる膜たんぱく質(バンド3)の立体構造を解明した。
- 立体構造情報から、バンド3の輸送機能が明らかになり、疾患に関係する部位や、バンド3の機能と構造変化の関係が示唆された。
- 遺伝性貧血などの疾患が発症する仕組みの解明や薬剤の分子設計につながると期待される。
概要
血液中に含まれる赤血球は、生命維持に必須の酸素を肺から体内に循環しています。これまでの研究から、赤血球は血液中の二酸化炭素を取り込み、赤血球内で重炭酸イオンと水素イオンに分解し、赤血球内のpHを変化させることで、ヘモグロビンに結合した酸素の放出を促すことが知られています。赤血球の膜(赤血球膜)に存在する膜たんぱく質「バンド3」は、赤血球内で生成した重炭酸イオンを外に放出し、代わりに塩素イオンを取り込む「交換輸送」を担っており、赤血球が適切な量の酸素を組織へ供給するのに欠かせない役割を担っています。
本研究グループでは、抗体フラグメントを結晶化の促進因子として用いる独自技術により、ヒトのバンド3を結晶化することに成功し、その立体構造を原子レベルで解明しました。得られた立体構造は、赤血球膜を貫通する7本のヘリックスの束でドメインを構成し、二つのドメインが逆向きに繰り返す構造を持っていました。このような二つのドメイン構造は、アミノ酸配列はあまり似ていないものの、ウラシル輸送体の立体構造と似ていることが分かりました。そこで、バンド3とウラシル輸送体の立体構造を詳しく比較したところ、片方のドメイン(コアドメイン)が動くことで、バンド3は塩素イオンを取り込み、重炭酸イオンを放出することが示唆されました(図)。また、赤血球の疾患に関係する変異が、このコアドメインに集中して存在することも明らかになりました。
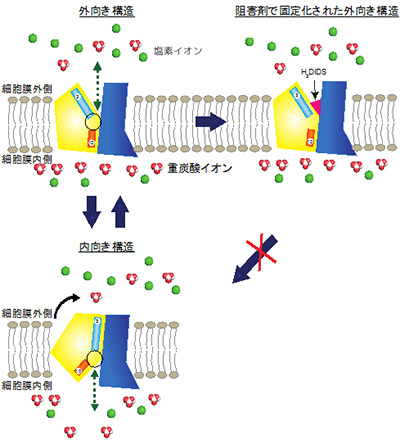
図 バンド3の輸送機能予測モデル
バンド3は、赤血球の外側に開いた状態で、阻害剤が結合し全体の立体構造を安定化している。この外向きの状態に、血液中の塩素イオン(緑色のボール)がバンド3のコアドメイン(黄色)に結合し、コアドメインが動くことで赤血球内に塩素イオンが取り込まれる。重炭酸イオン(白と赤のボール)は塩素イオンの代わりにバンド3に結合し、コアドメインが動くことで、重炭酸イオンが赤血球の外に放出される。
詳しい研究内容について
書誌情報
[DOI] http://dx.doi.org/10.1126/science.aaa4335
Takatoshi Arakawa, Takami Kobayashi-Yurugi, Yilmaz Alguel, Hiroko Iwanari, Hinako Hatae, Momi Iwata, Yoshito Abe, Tomoya Hino, Chiyo Ikeda-Suno, Hiroyuki Kuma, Dongchon Kang, Takeshi Murata, Takao Hamakubo, Alexander D. Cameron, Takuya Kobayashi, Naotaka Hamasaki, So Iwata
"Crystal structure of the anion exchanger domain of human erythrocyte band 3"
Science, Vol. 350 no. 6261 pp. 680-684, 6 NOVEMBER 2015
- 京都新聞(11月6日 27面)および科学新聞(12月1日 2面)に掲載されました。





