星美奈子 医学研究科特定准教授(先端医療振興財団客員上席研究員)は、Yoshitaka Ishii University of Illinois at Chicago教授およびRuth Nussinov National Cancer Institute at Frederick主任研究員のグループとの共同研究を行い、アルツハイマー病の患者脳において、老人斑の中でも特に疾患初期に蓄積すると考えられるタイプに固有と考えられる繊維状アミロイドβタンパク質の新たな立体構造を発見しました。
本研究成果は、日本時間2015年5月5日午前9時(英国時間2015年5月5日午後4時)、英国科学誌「Nature Structural & Molecular Biology」誌の電子版に掲載されました。
研究者からのコメント
42残基のアミロイドβペプチドは、疎水性残基が連続しているために合成が非常に困難な難合成ペプチドとして知られています。我々が培った技術により、極めて高品質なアミロイドβの調製に成功し、それが今回の発見に繋がりました。今後は、Ishii教授との共同研究をさらに広げ、実際に、患者脳由来の試料を使って構造解析を進める予定です。
概要
アルツハイマー病は、40から43残基の長さを持つAβペプチドが集合し毒性を持つことで発症すると考えられています。Aβは、ペプチド自身が複数の種類があること、環境に応じて様々な集合体を作り、その機能が異なることから、構造解析が最も必要とされながらも、最もハードルが高い領域の一つと考えられています。今回、サンプル調製を工夫することで、Aβの中でも42残基のもの(Aβ1-42と記載)だけが形成出来る、トリプルβシートという新たな立体構造を固体NMRによって明らかにすることに成功しました。
これまで、Ab1-42の方がAb1-40に比べて凝集体を形成しやすいこと、形成された凝集体の毒性が高いことが解っており。さらに、疾患初期に認められる老人斑ではAb1-42から形成されていること、遺伝的な家族性のアルツハイマー病ではAβ1-42の形成効率が高まることなど、Aβ1-42の方がより発症を促進している可能性が示唆されていましたが、それが分子レベルではどういう違いをもたらしているかは全く解りませんでしたが、本成果は、その違いについて初めて分子レベルで解き明かすことに成功しました。さらにそれだけではなく、Aβ1-42による構造はAβ1-40に伝播されないことを初めて明確に示したことで、アルツハイマー病の初期において、1カ所で凝集が起きれば、配列に依存して構造が増幅されていく可能性を提示しました。
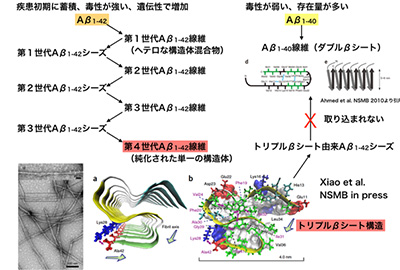
アミロイドβの42番目のアミノ酸がスイッチとなりS型のトリプルβシート構造が出来る
詳しい研究内容について
NMR法によりアルツハイマー病の初期過程にアミロイドタンパク質に起こる新たな構造変化とその伝播に迫る書誌情報
[DOI] http://dx.doi.org/10.1038/nsmb.2991
Yiling Xiao, Buyong Ma, Dan McElheny, Sudhakar Parthasarathy, Fei Long, Minako Hoshi, Ruth Nussinov & Yoshitaka Ishii
"Aβ(1–42) fibril structure illuminates self-recognition and replication of amyloid in Alzheimer's disease"
Nature Structural & Molecular Biology Published online 04 May 2015
- 京都新聞(5月23日 9面)に掲載されました。
関連リンク
- Danger, S-Bends! New Structure for Aβ42 Fibrils Comes into View (ALZFORUM、英語)
http://www.alzforum.org/news/research-news/danger-s-bends-new-structure-av42-fibrils-comes-view





