里村淳 農学研究科博士後期課程学生、黒田浩一 同准教授、植田充美 同教授らの研究グループは、プロペプチドというペプチド配列に着目することで、アンフィンセン説を覆す「プロテインフォールディングメモリー」という現象を明らかにしました。
本研究成果は、日本時間2015年5月14日午前3時(米国東部時間2015年5月13日午後2時)、米国科学誌「PLOS ONE」誌に掲載されました。
研究者からのコメント

左から黒田准教授、里村氏、植田教授
本研究では、プロペプチドによるフォールディング(折りたたみ)インプリント作用を利用することで、同じアミノ酸配列でも異なる安定性と活性を示す酵素タンパク質リパーゼ(芳香やバイオジェット燃料の作製の生体触媒)の創製に成功しました。一般にタンパク質は自身のアミノ酸配列がもつ情報によって、最も安定な状態までフォールディングされていると考えられていました。しかし、我々はアミノ酸配列が同じにもかかわらず、さらに安定性の高い状態までフォールディングされるタンパク質の作製に成功しました。本研究は、フォールディングに関わる遺伝病など、現代科学が抱える未知のタンパク質のフォールディング機構の基礎解析に、「プロテイン フォールディングメモリー」という新たな洞察を与えるものと考えています。
概要
ほとんど全てのタンパク質は機能を発するために、正しくフォールディングされる必要があります。これまで、タンパク質のフォールディングは自身のアミノ酸配列によって一義的に決まると考えられていました。これは1972年にノーベル化学賞を受賞したアンフィンセンにより提唱された説で、タンパク質はそのアミノ酸配列がもつ情報によって、最小のエネルギー状態まで折りたたまれるということを示しています。
本研究はプロペプチドというペプチド配列に着目することで、アンフィンセン説を覆す「プロテインフォールディングメモリー」という現象を明らかにしました。プロペプチドとはプロテアーゼやリパーゼの前駆体タンパク質に見られる短いペプチド配列です。プロペプチドは成熟体部分と相互作用することで、自身の構造をインプリントした(鋳型とした)後、切断除去されます。本研究では、酵素リパーゼのプロペプチドに変異を導入すると、プロペプチドのフォールディングインプリント作用が変化することで、より安定性の高く、基質特性が変化した成熟酵素ができることがわかりました。変異プロペプチドは元の野生型プロペプチドと同様に成熟酵素から切断されるため、完成した酵素タンパク質のアミノ酸配列は変化しません。同じアミノ酸配列でも活性や安定性が異なるタンパク質ができた点で新規性があると言えます。
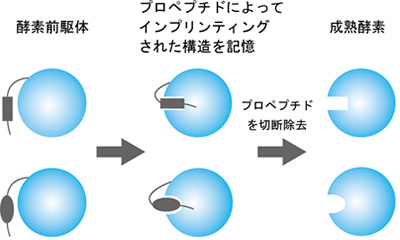
同じアミノ酸配列、異なる安定性, 構造、活性を有する
詳しい研究内容について
ノーベル賞受賞アンフィンセン説を覆すタンパク質ができた書誌情報
[DOI] http://dx.doi.org/10.1371/journal.pone.0124545
[KURENAIアクセスURL] http://hdl.handle.net/2433/210282
Atsushi Satomura, Kouichi Kuroda, Mitsuyoshi Ueda
"Generation of a Functionally Distinct Rhizopus oryzae Lipase through Protein Folding Memory"
PLOS ONE 10(5): e0124545 Published: May 13, 2015
- 京都新聞(5月23日 9面)に掲載されました。





