2014年3月4日
加藤博章 薬学研究科教授(理化学研究所客員研究員を兼務)、植田和光 物質-細胞統合システム拠点(iCeMS)教授、平竹潤 化学研究所教授、菅裕明 東京大学理学系研究科教授らの研究グループは、がん化学療法の障害となっているABC多剤排出トランスポーターと非常によく似た構造と機能を示す膜タンパク質CmABCB1を温泉に棲む真核生物から発見し、その分子構造と多剤排出メカニズムを解明しました。
本研究成果は、米国科学アカデミー機関誌「Proceedings of the National Academy of Sciences」の先行オンライン版に掲載されました。

左から小段篤史 iCeMS助教、加藤教授、植田教授
今回の成果により、多剤排出の基本的な仕組み、また、ABCB1に特異的に結合する阻害剤の新たな設計指針が明らかになりました。
今後は、CmABCB1の作用に伴う動きの全貌を解明し、ABC多剤排出トランスポーターの仕組みと弱点を詳しく解明する予定です。また、CmABCB1で判明したことが、ヒトABCB1についても当てはまるかどうかの研究を進め、がんの化学療法を阻害する原因を解明し、抗がん剤などの創薬研究の進展や薬物治療の改良に役立てたいと考えています。
ポイント
- P糖タンパク質(ヒトABC多剤排出トランスポーター)と構造および機能が相同のCmABCB1を、温泉に棲む真核生物から世界で初めて発見
- CmABCB1の原子分解能の構造をX線結晶解析で決定
- CmABCB1の動きを止めるユニークな阻害剤を発見し、阻害様式を解明
- CmABCB1が多種多様な化合物を排出するメカニズムを原子レベルで解明
概要
生物はトランスポーターという膜タンパク質を用いて細胞膜の内外の物質輸送を行っています。中でもATPをその駆動エネルギーとして作用するものがABC(ATP Binding Cassette:ATP結合カセット)トランスポーターと呼ばれています。特に有名なのがP糖タンパク質(またはMDR1)ともよばれるABCB1で、多種多様な化学構造の化合物を細胞外へと排出することが知られています。ABCB1は、小腸、血液脳関門、肝臓、腎臓、生殖器に多く存在しており、外界の異物から生体を守る役割を果たしています。一方で、経口投与された薬もABCB1によって体外へと排出されることから、ABCB1との相性が薬の効力と大きく関係しています。
生体防御の要であるABCB1ですが、最初の抗がん剤治療で残ったがん細胞が、ABCB1を多数作ることによって多様な抗がん剤に耐性を獲得することは化学療法の障害となっています。したがって、ABCB1の分子構造を解明することにより、この多剤排出という不思議な機能を解明することは、基礎科学的に重要なことはもちろん、創薬や医療にとっても重要な意義をもっています。
この多剤排出というABCB1の不思議なメカニズムを明らかにするために、本研究グループをはじめ、世界中の研究者が結晶構造解析を30年近く試みてきましたが、ABCB1は細胞から取り出すと安定性が低く、詳細な分子構造の決定はこれまで不可能でした。
そこで、本研究グループは、高温に棲む生物から性質の良く似た分子を探すことにしました。そして、シゾン(Cyanidioschyzon merolae)という温泉に棲む真核生物に着目し、ヒトABCB1と遺伝子配列の良く似たCmABCB1を発見しました。さらにX線結晶構造解析の手法を用いて、その分子構造を詳細に解明することにより、多様な化学構造の分子を排出する仕組みを明らかにしました。
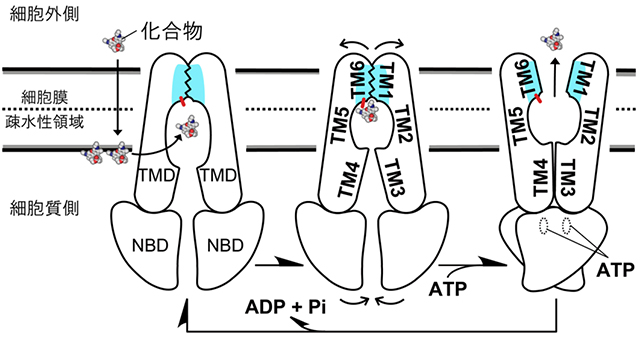
多剤排出のメカニズム
詳しい研究内容について
がん化学療法の障害となる多剤排出トランスポーターの結晶構造 -体内動態や脳内移行に優れたくすりの開発にも期待-
書誌情報
[DOI] http://dx.doi.org/10.1073/pnas.1321562111
Atsushi Kodan, Tomohiro Yamaguchi, Toru Nakatsu, Keita Sakiyama, Christopher J. Hipolito, Akane Fujioka, Ryo Hirokane, Keiji Ikeguchi, Bunta Watanabe, Jun Hiratake, Yasuhisa Kimura, Hiroaki Suga, Kazumitsu Ueda, and Hiroaki Kato
"Structural basis for gating mechanisms of a eukaryotic P-glycoprotein homolog"
PNAS Early Edition published ahead of print March 3, 2014
掲載情報
- 京都新聞(3月4日 29面)、日刊工業新聞(3月4日 19面)および読売新聞(3月31日 17面)に掲載されました。

