2013年11月1日

影山教授
影山龍一郎 ウイルス研究所教授/物質-細胞統合システム拠点(iCeMS=アイセムス)教授、今吉格 ウイルス研究所特定准教授(白眉センター所属)、磯村彰宏 同研究員らの研究グループは、神経幹細胞の多分化能と細胞分化制御において、分化運命決定因子が周期的に発現していることが重要であることを発見しました。この知見をもとに、マウスの神経幹細胞の増殖と神経細胞への分化を、光照射にて人工的に制御する技術を開発しました。
本研究成果が、「Science」のオンライン版に掲載されました。
ポイント
- 神経幹細胞が多分化能を備えつつ増える(自己複製する)ためには、運命決定因子がリズムを刻んでいることが重要
- マウスの神経幹細胞の自己複製とニューロン分化誘導を「光」で制御できる技術を開発
- 自己複製能と多分化能の両立という神経幹細胞を幹細胞たらしめている根幹のメカニズムを解明
背景
神経幹細胞は、自己複製を行うことができ、かつ脳を構成する主要な3種類の細胞であるニューロン、アストロサイト、オリゴデンドロサイトを生み出す多分化能を持ちます(図1)。神経幹細胞の自己複製と細胞分化制御機構の解明は、脳神経系の発生機構の解明に繋がるだけでなく、脳損傷や神経変性疾患に対する再生医療の実現に向けた基盤的知識になります。しかし、自己複製能(分化することなく、自分のコピーを作ることができる)と、多分化能(さまざまな細胞に分化できる)というまったく異なる能力をどのようなメカニズムで神経幹細胞は保持しているのかは不明でした。また、神経幹細胞が細胞分化を行う際に、ニューロン、アストロサイト、およびオリゴデンドロサイトという3種類の選択肢の中から、どのように一つの選択肢を選んで分化していく(細胞分化運命決定)のかについてもよくわかっていませんでした。
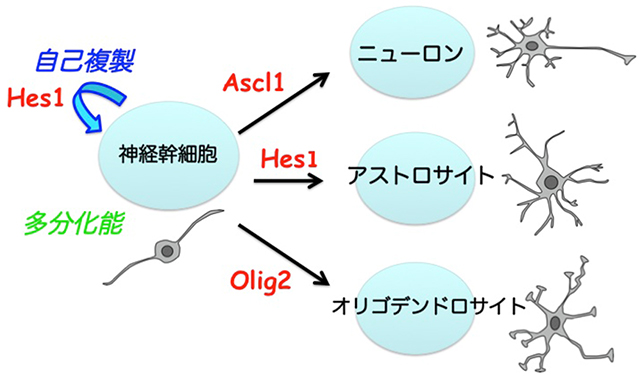
図1:神経幹細胞は、自己複製を行うことができ、かつ多分化能を持つ。
研究の内容
神経幹細胞の自己複製と細胞分化はbHLH型転写因子によって制御されています。神経幹細胞の未分化性の維持とアストロサイト分化を制御するHes1、ニューロン分化を制御するAscl1、オリゴデンドロサイト分化を制御するOlig2という三種類のbHLH型転写因子が重要な働きを担っていることが知られています。しかし、Hes1がどのようなメカニズムで幹細胞の未分化性維持とアストロサイト分化という相反する二つの機能を発揮するのかよくわかっていません。また、Ascl1やOlig2は、ニューロン分化とオリゴデンドロサイト分化以外に、神経幹細胞の増殖・維持にも重要であることが知られていますが、この相反する機能をどのように制御しているのかも不明でした。本研究では、ホタルの発光たんぱく質であるルシフェラーゼとbHLH型転写因子の融合たんぱく質が発現するような遺伝子改変マウスを作製し、bHLH型転写因子の発現動態を解析しました。また、Hes1、Ascl1、Olig2の3種類のbHLH型転写因子について、ルシフェラーゼとの融合たんぱく質の発現動態を観察・解析しました。
顕微鏡システムや画像解析法の至適化により、単一細胞レベルで、細胞分化運命決定因子であるbHLH型転写因子たんぱく質のリアルタイムイメージングに成功しました。その結果、神経幹細胞においてHes1、Ascl1たんぱく質は2~3時間周期で、Olig2たんぱく質は5~8時間周期で周期的に発現(発現振動)していることが明らかになりました(図2)。さらに、Hes1、Ascl1、Olig2のいずれかを欠損した神経幹細胞では細胞増殖が減少していたことから、bHLH型転写因子が発現振動を繰り返すことによって神経幹細胞の細胞分裂を促進することが示唆されました。
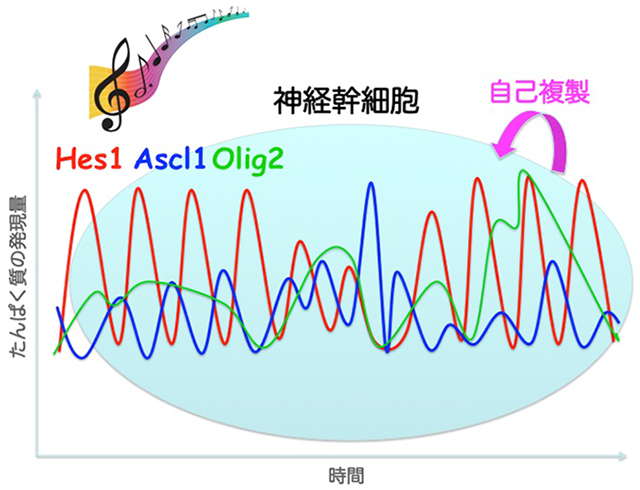
図2:自己複製する神経幹細胞において、Hes1、Ascl1、およびOlig2の発現は発現振動する。
次に、神経幹細胞に細胞分化を誘導して、Hes1、Ascl1、Olig2たんぱく質の発現動態をリアルタイムイメージングにて解析しました。その結果、ニューロン分化の際にはAscl1が、アストロサイト分化の際にはHes1が、オリゴデンドロサイト分化の際にはOlig2がそれぞれ蓄積することが明らかになりました(図3)。神経幹細胞からどれかの細胞種に分化運命決定が行われる際には、発現振動を繰り返していたHes1、Ascl1、Olig2たんぱく質のどれか1種類の発現レベルが上昇し、他の2種類のたんぱく質の発現が消失しました。
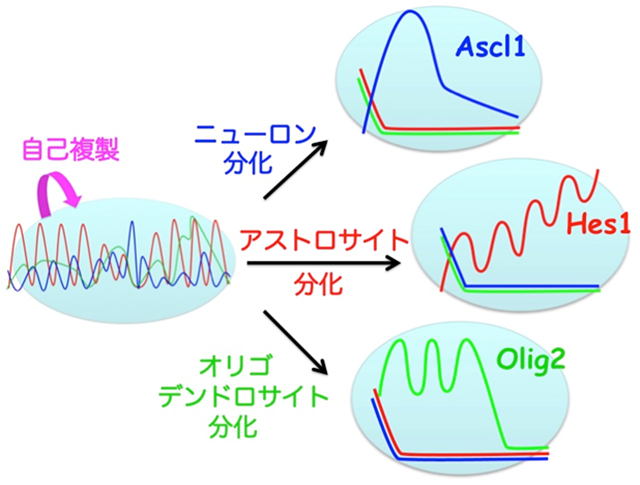
図3:神経幹細胞から分化運命決定が行われる際には、発現振動を繰り返していたHes1、Ascl1、Olig2たんぱく質のどれか1種類の発現レベルが上昇し、他の2種類のたんぱく質の発現が消失する。
ルシフェラーゼとbHLH型転写因子の融合たんぱく質の発現動態の観察結果から、Hes1、Ascl1、Olig2などの細胞分化決定因子は、神経幹細胞にもすでに発現しており、発現振動を繰り返すことで神経幹細胞の増殖を促進すると考えられました。一方、細胞分化誘導時にはどれか1種類のbHLH因子の発現が上昇し、細胞分化を促進することが明らかになりました。神経幹細胞は、複数の細胞分化決定因子をオシレーションさせることで、多分化能を備えつつも未分化性を保持して自身のコピーを作る(自己複製する)と考えられました。
上記の結果から、同一因子が発現動態を変えることによって神経幹細胞の増殖を活性化したり、特定の種類の細胞に分化誘導することが示唆されました。たとえば、Ascl1は発現振動すると神経幹細胞の増殖を活性化し、蓄積するとニューロン分化を誘導すると考えられました。そこで、光応答性の転写因子であるGAVPOのコドンをヒト化したhGAVPOを用いて、光照射依存的にAscl1の発現動態を人工的にコントロールできる実験系を開発しました(図4)。3時間ごとに青色光を照射することでAscl1のオシレーションを、30分ごとに青色光を照射することでAscl1の蓄積を神経幹細胞に誘導できました。
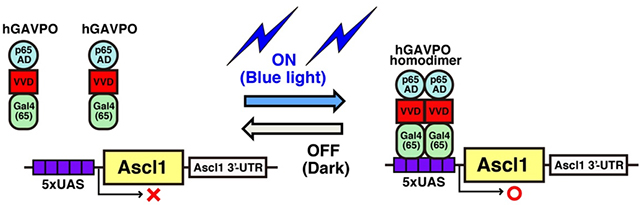
図4:光応答性の転写因子hGAVPOを用いたAscl1の人工的発現誘導系。hGAVPOは青色光の照射により2量体を形成し、UASの下流に配置したAscl1の発現を誘導する。
神経幹細胞に青色光照射を行い、Ascl1の3時間周期の発現振動を誘導したところ、細胞増殖(自己複製)が促進されました。一方、Ascl1の蓄積を誘導したところ、ニューロン分化が誘導されました(図5)。すなわち、従来用いられてきた外来性のたんぱく質や化合物を投与することなく、青色光の照射パターンを変えるだけで、神経幹細胞の増殖やニューロン分化を自在にコントロール可能な技術開発に成功しました。この技術は、今後再生医療研究に貢献することが期待されます。また、光照射による神経幹細胞の増殖・分化を制御する実験技術は、マウス脳内の神経幹細胞にも適応できる可能性があり、今後の実用化に向けて開発を推進したいと考えています。
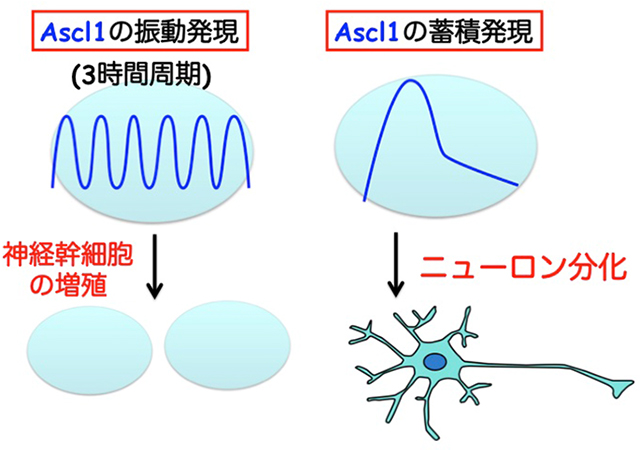
図5:光遺伝学的発現操作技術を用いて、Ascl1を3時間周期で発現振動(オシレーション)させたところ、細胞増殖が促進された。一方、Ascl1を蓄積発現させたところ、ニューロン分化が誘導された。
波及効果
本研究は、自己複製能と多分化能の両立という神経幹細胞を幹細胞たらしめている根幹のメカニズムを明らかにしました。Hes1たんぱく質は、神経幹細胞だけではなく、万能細胞(ES細胞、iPS細胞)や造血幹細胞、皮膚幹細胞などほとんどの幹細胞で発現が確認されていることから、本研究で見い出された細胞分化決定因子の発現振動による制御機構は、他の種類の幹細胞においても普遍的に使用されているメカニズムであると考えられ、幹細胞研究全体への幅広い波及効果が予想されます。
今後の予定
神経幹細胞の自己複製とニューロン分化誘導を「光」で制御できる技術は、脳損傷や神経変性疾患に対する再生医療研究に貢献することが期待されます。また、光照射による神経幹細胞の増殖・分化コントロール技術は、脳内の神経幹細胞にも適応できる可能性があります。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)、基盤研究(A)、若手研究(A)、新学術領域研究「大脳新皮質構築」、武田財団の支援を受けました。
書誌情報
[DOI] http://dx.doi.org/10.1126/science.1242366
[KURENAIアクセスURL] http://hdl.handle.net/2433/179383
Itaru Imayoshi, Akihiro Isomura, Yukiko Harima, Kyogo Kawaguchi, Hiroshi Kori, Hitoshi Miyachi, Takahiro Fujiwara, Fumiyoshi Ishidate, and Ryoichiro Kageyama
"Oscillatory Control of Factors Determining Multipotency and Fate in Mouse Neural Progenitors"
Science 1242366 Published online 31 October 2013
- 京都新聞(11月1日 23面)、日刊工業新聞(11月1日 25面)、日本経済新聞(11月1日 42面)、毎日新聞(11月1日夕刊 7面)、読売新聞(2月24日 21面)および科学新聞(11月22日 4面)に掲載されました。

