2013年8月19日

左から小川教授、昆彩奈 東京大学大学院生
小川誠司 医学研究科教授、宮野悟 東京大学医科学研究所教授、白髭克彦 同分子生物学研究所教授、Lee-Yung Shih 台湾長夷記念病院教授、Torsten Haferlach ドイツミュンヘン白血病研究所教授、油谷浩幸 東京大学先端科学技術研究センター教授、中内啓光 同医科学研究所教授、森啓 昭和大学血液内科教授、千葉滋 筑波大学血液内科教授、宮脇修一 都立大塚病院血液内科部長、H.Phillip Koeffler 米国Ceders-Sinai病院教授、Wolf-Karsten Hofmann ドイツマンハイム大学教授らによる国際共同研究チームは、600例以上のMDSやAMLの症例を対象として高速ゲノムシーケンス技術を用いたゲノム解析を行い、「コヒーシン」と呼ばれる、細胞分裂や遺伝子の転写調節において重要な働きを有することが知られているタンパク質複合体を構成する遺伝子の変異が、骨髄異形成症候群(MDS)、 慢性骨髄単球性白血病(CMML)、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)などの「骨髄系腫瘍」に分類される血液がんで高頻度に認められることを解明しました。
本研究の成果は、米国科学雑誌「Nature Genetics」(日本時間2013年8月19日(月曜日)午前2時)電子版にて公開されました。
背景
骨髄異形成症候群(以下MDS)は、白血病などと並ぶ代表的な「血液がん」の一つです。日本でも推定で数万人の患者がおり、年間5,000人以上が新たに発症し、高齢者の増加により患者数が近年増加しています。MDSは、造血細胞ががん化することによって正常な血液細胞を作ることができなくなる結果、感染症、貧血、出血といった症状を生じる極めて難治性の血液がんの一つです。現在は造血幹細胞移植を除いて根治的な治療手段はありませんが、高齢者が本症に罹患することも多いことから、身体への負担が少ない治療法の開発が求められています。一方、MDSをはじめとして「がん」は「ゲノム」の異常(遺伝子変異)によっておこる病気であると考えられていますが、本研究では、大規模なシーケンス解析によって、コヒーシンと呼ばれる蛋白複合体の変異がMDSの発症に重要な役割を担っていることが明らかになりました。
研究の主な成果
- MDSの全エクソンシーケンスにより、コヒーシン複合体を構成する四つの遺伝子の変異が重要な遺伝子変異であることが明らかになった。
- 600例を越える症例についてコヒーシンの遺伝子変異を調べた結果、コヒーシン複合体を構成する四つの遺伝子の変異が、MDS、 CMML、AML、CMLにおいて高頻度に認められ、これらの遺伝子変異は互いに排他的に生じていることが明らかになった。
- コヒ―シン遺伝子の変異した白血病の患者由来の細胞株では、コヒーシン複合体の染色体への結合が減少していることが示された。
- コヒ―シン遺伝子の変異した白血病の患者由来の細胞株に、正常なコヒーシン遺伝子を発現させて補うと、白血病細胞株の異常な増殖が抑制されることから、コヒーシン遺伝子はがん抑制遺伝子として働くことが支持された。
研究の内容
次世代シークエンサーとスーパーコンピュータによる塩基配列の解読
本研究チームは、最先端の遺伝子解析技術を駆使してMDSなどの血液がんの遺伝子解析を行いました。
がん細胞において生じている遺伝子異常は、症例によっても大きく異なるため、MDSにおける遺伝子変異のプロファイルを明らかとするためには、多数の症例を対象として、網羅的にゲノムの塩基配列を解読することが重要です。このため、まずMDS 29例についてゲノムのうちタンパク質をコードする領域(エクソン)の全塩基配列を徹底的に解読することにより(全エクソンシーケンス)、MDSで生じている遺伝子変異を同定しました。今回の研究には、次世代シークエンサーによる塩基配列情報の収集と、スーパーコンピュータによる高速度のデータ解析が中心的な役割を担いました。今後大量シーケンスを用いたがんの研究と予後予測・新規治療薬の開発などMDSの臨床への応用が期待されます。
MDSにおいて新たに発見された遺伝子変異
MDSではこれまでにDNA修飾やクロマチン修飾に関わる遺伝子のほか、最近ではRNAスプライシング因子の変異などが原因として知られていましたが、本研究の全エクソンシーケンスの解析では、これまでに知られている遺伝子以外に新たに多くの遺伝子の変異がみつかりました。その遺伝子変異のほとんどは一試料でのみ異常が観察されたものでしたが、今回発見されたコヒーシン遺伝子の変異は、複数の症例で変異していることが観察されたことから、本症の発症においてより重要度の高い遺伝子であると考えられました。また、コヒーシン遺伝子の変異は、MDSおよびAMLの原因遺伝子としてこれまでに知られていた種類の遺伝子変異とは全く異なるグループに属する遺伝子でした。
コヒーシン遺伝子変異はMDSやAMLにおいて頻発する遺伝子変異である
「コヒーシン」は、STAG、RAD21、SMC1、SMC3という四つのタンパク質から構成されるタンパク質複合体です。細胞が分裂する際には、まず1本の染色体(DNA情報の運び屋)は複製されて2本になり(複製された結果生じた1対の染色体を姉妹染色体とよぶ)、新しく生じる二つの細胞(娘細胞とよぶ)それぞれに、同じ染色体が正確に分配される結果、元の細胞と同じ遺伝子情報をもつ娘細胞が二つ作られます。しかし、染色体は糸状の長い構造をとっているため、姉妹染色体を正確に分配することは容易なことではありません。コヒーシン複合体を構成する四つのタンパク質は、リング状の形状をとることにより、細胞分裂の開始時から終了直前まで姉妹染色体を取り囲み、細胞分裂時に姉妹染色体が異常に分配されてしまうことを防ぐ機能を有することが知られていました(図1)。また、最近では、コヒーシンは遺伝子の転写調節において重要な役割を果たすことが報告され注目を集めています。これまで、子供の先天性の病気である「コルネリア・デ・ランゲ症候群」でコヒーシン遺伝子の変異が生じていることが知られていました。
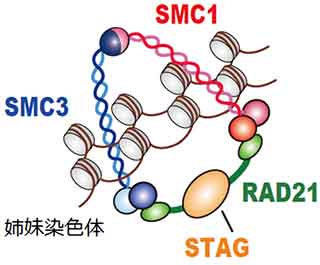
図1:コヒーシン複合体の模式図
コヒーシンは、STAG2、RAD21、SMC1A、SMC3という四つのタンパク質からなる複合体であり、細胞が分裂するときに、リング状の構造をとって染色体を束ね、姉妹染色体が二つの娘細胞に正確に分配されるために重要な役割を果たしている。コヒーシン複合体が正常に機能しなくなると、細胞分裂後に染色体の数の異常がおこることが知られている。また、コヒーシンは遺伝子の転写調節において重要な役割を果たすことが知られている。
コヒーシン遺伝子のMDSやAMLなどの血液がんでの頻度変異を調べるため、さまざまな病型の血液がんを含む610例の患者さん由来のDNA試料について、高速シーケンサーを用いた解析を行いました。その結果、さまざまな病型の血液がんで変異がみられ(図2)、MDSの8%、MDSの病型の一つである慢性骨髄単球性白血病(CMML)の10%、AMLの12%、慢性骨髄性白血病(CML)の6%に遺伝子変異が生じていることが確認されました。
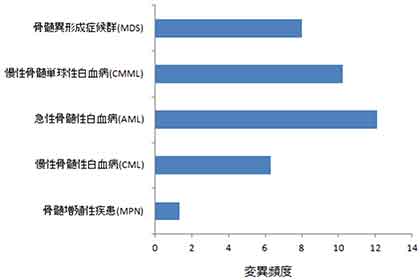
図2:さまざまな病型の血液がんでみつかったコヒーシン遺伝子変異の頻度
コヒーシン遺伝子の変異は、MDS、CMML、AMLにおいてより高頻度にみられることが明らかになった。一方、骨髄増殖性疾患(MPN)では変異の頻度は低かった。
さらに重要なことに、コヒーシンの四つの遺伝子にみつかった変異の大部分は、互いに重複なく「排他的に」生じていました(図3)。このことは、コヒーシンを構成する四つの遺伝子のどの遺伝子に変異が生じても、共通の機序を通じて白血病化を招くことを示唆していると考えられます。
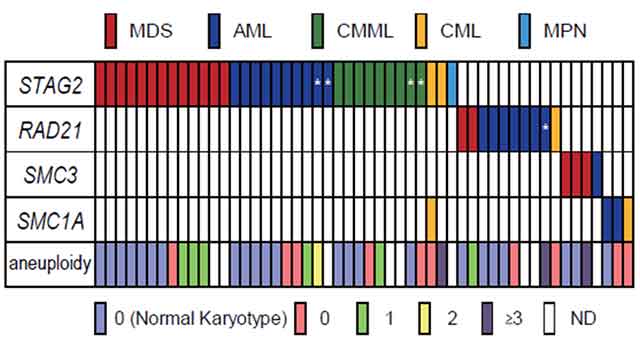
図3:遺伝子変異のほとんどは互いに重複なく排他的に生じていた
コヒーシンの四つの遺伝子にみつかった変異の大部分は、互いに重複なく「排他的に」生じていた。このことは、コヒーシンを構成する四つの遺伝子のどの遺伝子に変異が生じても、共通の機序を通じて白血病化を招くことを示唆している。
また、見つかったコヒーシン遺伝子の変異のうち約60%はSTAG2という遺伝子にみつかりました。STAG2とRAD21でみつかった遺伝子変異は、アミノ酸をコードするコーディング領域全体に認められ、変異により正常型のタンパク質よりも短い不完全なタンパク質が作られることがわかりました。また、SMC1A、SMC3の変異は、コヒーシンがリング状の複合体を形成するために重要と考えてられている部位に生じていました。このことは、これらの遺伝子の変異はタンパク質の機能の喪失につながる変異であり、これらの遺伝子は「がん抑制遺伝子」として機能していることを示しています(図4)。
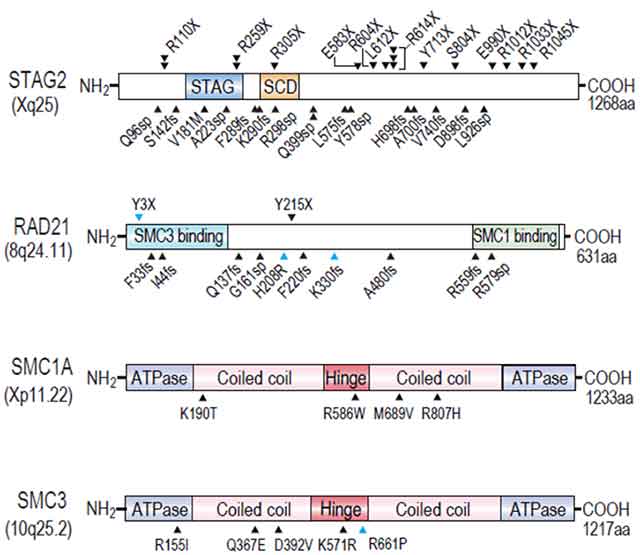
図4:610例のさまざまな病形の血液がんの遺伝子変異解析によって同定されたコヒーシン遺伝子変異
STAG2とRAD21遺伝子にみられた遺伝子変異はアミノ酸コード領域(コーディング領域)に広く生じていた。SMC1A、SMC3の変異は、コヒーシンがリング状の複合体を形成するために重要と考えてられている部位に生じていた。これらの遺伝子の変異はタンパク質の機能の喪失につながる変異であると考えられた。
また、約300症例において、コヒーシンの遺伝子変異と、これまで骨髄系腫瘍で変異が知られている遺伝子の変異を調べた結果、TET2やEZH2などの、MDSやAMLの原因遺伝子であることがこれまでに知られていた遺伝子変異と共存する確率が高いことがわかりました(図5)。
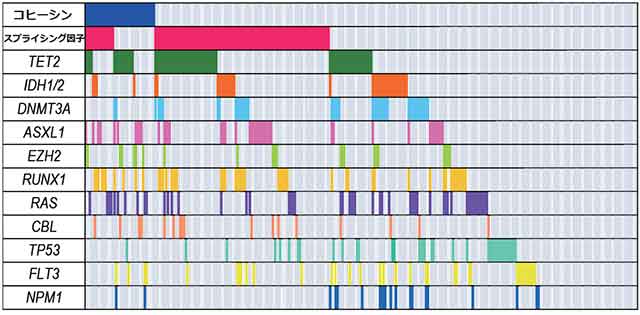
図5:コヒーシン遺伝子の変異と、これまで知られていた遺伝子の変異との関係
310症例の骨髄系腫瘍においてコヒーシン遺伝子変異と、これまでに知られている遺伝子変異との関係を調べた。コヒーシン遺伝子の変異は、多くの遺伝子変異と共存しており、とくにTET2、ASXL1、EZH2と共存しやすいことがわかった。
コヒーシン遺伝子の変異による白血病発症のメカニズム
今回の研究において、複数の白血病由来細胞株を用いて染色体に結合しているコヒーシンタンパクの量を調べたところ、コヒーシン遺伝子が変異していたり、タンパク質の発現量が減少したりしている白血病由来の細胞株では、コヒーシン複合体の染色体への結合が減少していることが示されました。造血細胞においてコヒーシン複合体を構成する遺伝子のいずれかに変異が生じると、コヒーシンがリング状の構造をとれなくなり、そのためにコヒーシンが染色体に結合できにくくなり、その結果、細胞分裂の異常が生じたり、重要な遺伝子の転写調節の異常が生じたりすることにより、白血病化につながるという仮説が立てられます(図6)。
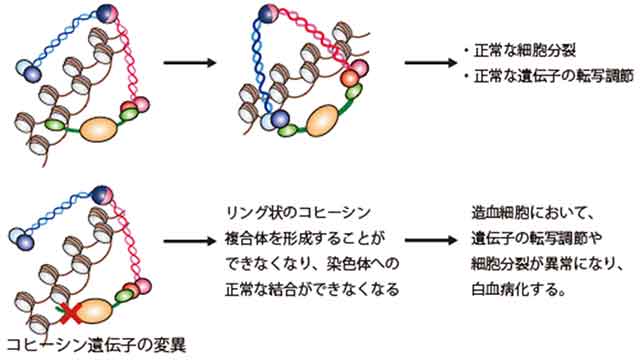
図6:コヒーシン遺伝子変異による白血病化のメカニズム
コヒーシン複合体は四つのタンパク質がリング状の複合体を形成することにより染色体を取り囲む。コヒーシン遺伝子に変異が生じると、正常なリング状の複合体の形成ができなくなり、その結果、コヒーシンの染色体への正常な結合が阻害されると考えられる。その結果、造血細胞の遺伝子の転写調節や細胞分裂においてコヒーシンの正常な機能が失われ、白血病化につながると考えられる。
また、コヒーシン遺伝子が変異した白血病の患者さん由来の細胞株で、正常なコヒーシンタンパク質を外因性に発現させると、細胞株の異常な増殖が抑制されることが観察されました(図7)。この結果からも正常型のコヒーシン遺伝子は「がん抑制遺伝子」として働いていて、造血細胞ががん化して異常な増殖をするのを防ぐ役割を果たしていると結論付けられました。
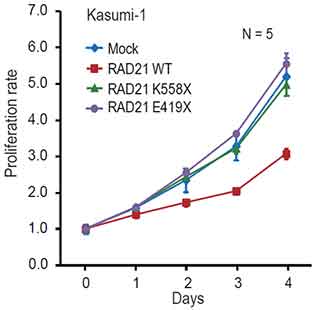
図7:コヒーシン遺伝子は「がん抑制遺伝子」として働く
コヒーシン遺伝子であるRAD21が変異した白血病の細胞株に、正常型(野生型)のRAD21タンパク質を導入すると細胞株の異常な増殖は抑制される。しかし、変異したRAD21タンパク質(図のRAD21 K558XおよびRAD21 E419X)を導入しても細胞増殖の抑制は見られない。このことは、正常型のRAD21遺伝子が「がん抑制遺伝子」として働いていることを支持する所見である。
今後の展開
今回の研究成果によって、コヒーシン遺伝子の変異がMDS、CMML、AML、CMLなどの「骨髄系腫瘍」に高頻度にみられる重要な遺伝子変異であることがわかりました。今後、骨髄系腫瘍の患者さんの診療において、コヒーシン遺伝子の変異をマーカーとして予後予測を行い、最適な治療法を選択することに役立つことが期待されます。また、コヒーシンの遺伝子変異はこれまで骨髄系腫瘍で知られてきた遺伝子変異とは異なる新たなグループに属する遺伝子変異であることから、コヒーシン遺伝子の変異を治療標的とした新たな創薬に期待がもたれます。
本成果は、以下の研究事業によって得られたものです。
- 文部科学省・日本科学技術振興機構 「次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)」 プログラムリーダー:野田哲生(公益財団法人がん研究会 がん研究所所長)
- 厚生労働省厚生労働科学研究費補助金 難治性疾患克服研究事業「不応性貧血の治癒率向上を目指した分子・免疫 病態研究」 研究代表者:小川誠司
- 文部科学省科学研究費補助金 新学術領域研究「システム的統合理解に基づくがんの先端的診断、治療、予防法の開発」 領域代表者:宮野悟 、計画研究代表研究者:小川誠司
- 文部科学省科学研究費補助金 基盤研究A 「白血病幹細胞の維持と再発に関わる遺伝学的基盤の解明」 研究代表者:小川誠司
- 内閣府 「最先端研究開発支援プログラム(FIRST)」 研究代表者:永井良三(自治医科大学学長)
- 経済産業省 独立行政法人新エネルギー・産業技術総合開発機構(NEDO) 研究代表者:油谷浩幸
書誌情報
[DOI] http://dx.doi.org/10.1038/ng.2731
Kon Ayana, Shih Lee-Yung, Minamino Masashi, Sanada Masashi, Shiraishi Yuichi, Nagata Yasunobu, Yoshida Kenichi, Okuno Yusuke, Bando Masashige, Nakato Ryuichiro, Ishikawa Shumpei, Sato-Otsubo Aiko, Nagae Genta, Nishimoto Aiko, Haferlach Claudia, Nowak Daniel, Sato Yusuke, Alpermann Tamara, Nagasaki Masao, Shimamura Teppei, Tanaka Hiroko, Chiba Kenichi,
Yamamoto Ryo, Yamaguchi Tomoyuki, Otsu Makoto, Obara Naoshi, Sakata-Yanagimoto Mamiko, Nakamaki Tsuyoshi, Ishiyama Ken, Nolte Florian, Hofmann Wolf-Karsten, Miyawaki Shuichi, Chiba Shigeru, Mori Hiraku, Nakauchi Hiromitsu, Koeffler H Phillip, Aburatani Hiroyuki, Haferlach Torsten, Shirahige Katsuhiko, Miyano Satoru, Ogawa Seishi.
Recurrent mutations in multiple components of the cohesin complex in myeloid neoplasms.
Nature Genetics, 2013/08/18/online
- 朝日新聞(8月19日 3面)、京都新聞(8月19日 24面)および日本経済新聞(8月19日 34面)に掲載されました。

