2013年7月8日
小川誠司 医学研究科教授(2013年3月まで東京大学医学部附属病院がんゲノミクスプロジェクト特任准教授)およびJaroslaw P Maciejewski 米国クリーブランド・クリニック教授、Yang Du 米国ユニフォームド・サービス保健大学教授、宮野悟 東京大学医科学研究所附属ヒトゲノム解析センター教授、小島勢二 名古屋大学医学系研究科教授、森啓 昭和大学医学部教授らを中心とする国際共同研究チームは、700例以上の骨髄異形成症候群(以下MDS)や白血病の症例を対象として高速ゲノムシーケンス技術を用いたゲノム解析を行い、SETBP1という遺伝子の変異がMDSから白血病への進行に関わっているということをつきとめました。ゲノム解析には、次世代シークエンサーによる塩基配列情報の収集と、宮野教授の協力のもと、スーパーコンピュータによる高速度のデータ解析を行いました。
本研究の成果は、米国科学雑誌「Nature Genetics」(日本時間2013年7月8日)電子版にて公開されました。
本研究の主な成果
- MDSの全エクソンシーケンスにより、SETBP1遺伝子の変異がMDSから白血病に進行する際の重要な遺伝子変異であることが明らかになった。
- 700例を越える症例についてSETBP1変異を調べた結果、SETBP1変異を有する患者群では変異を有しない患者群に比べて生命予後が不良であった。
- 変異型SETBP1遺伝子をマウス造血幹細胞に発現させると、白血病の特徴である不死化をきたすことが明らかになった。
研究の背景
MDSは、白血病などと並ぶ代表的な「血液がん」の一つです。日本でも推定で数万人の患者がおり、年間5,000人以上が新たに発症していて、高齢者の増加により患者数が年々増加しています。MDSは、血液細胞のがん化にともなって正常な血液細胞を作ることができなくなる結果、感染症、貧血、出血といった症状を生じる極めて難治性の血液がんの一つです。また、多くの症例がより急速に病気が進行する急性骨髄性白血病へ移行し、致死的な転帰をたどりますが、白血病への進行を予測する有効な指標は知られていませんでした。また、現在は骨髄移植を除いて根治的な治療手段はありませんが、高齢者が本症に罹患することも多いことから、身体への負担が少ない治療法の開発が求められています。一方、MDSをはじめとして「がん」は「ゲノム」の異常(遺伝子変異)によっておこる病気であると考えられており、どのような遺伝子の変異によってMDSが白血病へと進行するのかを明らかにするために本研究が行われました。
研究の内容
次世代シークエンサーとスーパーコンピュータによる塩基配列の解読
がん細胞において生じている遺伝子異常は、症例によっても大きく異なるため、MDSにおける遺伝子変異のプロファイルを明らかとするためには、多数の症例を対象として、網羅的にゲノムの塩基配列を解読することが重要です。このため、まず20例についてゲノムのうちタンパク質をコードする領域(エクソン)の全塩基配列を徹底的に解読することにより(全エクソンシーケンス)、MDSで生じている遺伝子変異を同定しました。今回の研究には、次世代シークエンサーによる塩基配列情報の収集と、スーパーコンピュータによる高速度のデータ解析が中心的な役割を担いました。今後大量シーケンスを用いたがんの研究と予後予測・新規治療薬の開発などMDSの臨床への応用が期待されます。
MDSにおいて新たに発見された遺伝子変異
MDSではこれまでにRNAスプライシング因子の遺伝子変異などが原因として知られていましたが、今回の20症例の解析では、従来から知られている遺伝子以外に新たに多くの遺伝子の変異がみつかりました。そのうち、MDSの病型の一つで、より白血病に近い進行した病型である「芽球増加を伴う不応性貧血」という病型の2症例でSETBP1という新しい遺伝子の変異が検出されました。
SETBP1という遺伝子はこれまでSchinzel-Giedion症候群という重症の精神遅滞、特徴的な顔立ち、多発先天奇形に特徴づけられる先天性疾患の原因遺伝子として知られていました。今回MDSでみつかったSETBP1遺伝子の異常はこのSchinzel-Giedion症候群で報告されているものと同じ、868番目のアスパラギン酸がアスパラギンに変化する遺伝子変異でした。
SETBP1遺伝子変異はMDSの白血病への進行に関わる
SETBP1遺伝子のMDSなどの血液がん全体での頻度変異を調べるため、他の血液がんを含む727例の試料について、SETBP1遺伝子の変異について検討しました。その結果、さまざまな病型の血液がんで変異がみられ(図1)、全体では52症例(7.2%)で変異が生じていることが確認されました。さらに、SETBP1遺伝子の変異はMDSから進行した症例が含まれる2次性白血病で16.8%、MDSの病型の一つである慢性骨髄単球性白血病(CMML)で14.5%と高い頻度で変異が生じていることが確認されました。一方、典型的な(MDSから進行した2次性ではない)急性骨髄性白血病では1%以下と低頻度であったことから、SETBP1遺伝子の変異は2次性白血病に特徴的な異常であることがわかりました。
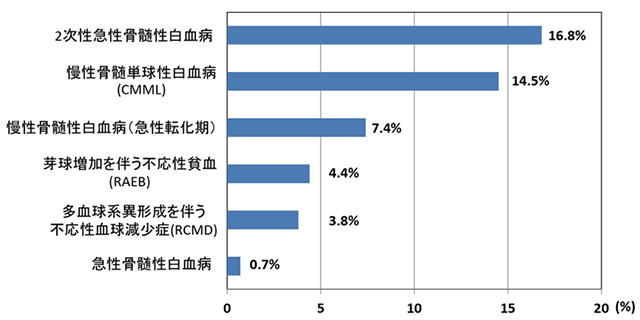
図1:さまざまな病型の血液がんでみつかったSETBP1遺伝子変異の頻度
SETBP1遺伝子の変異はMDSから進行した2次性の急性骨髄性白血病やMDSの病型の一つである慢性骨髄単球性白血病でより高頻度にみられることが明らかになった。一方、(2次性でない)典型的な急性骨髄性白血病では低頻度であり、SETBP1変異はMDSの進行に関わる遺伝子変異であることがわかった。
また、今回52症例でみつかったSETBP1遺伝子の変異は特定のアミノ酸に集中しており(図2)、特に、Schinzel-Giedion症候群でも報告がある868番目、869番目、871番目のアミノ酸に最も多く変異がみられていました。このことは、これらの変異したSETBP1遺伝子が、異常な活性を持った一種の「がん蛋白」として作用する可能性を示唆するものです。
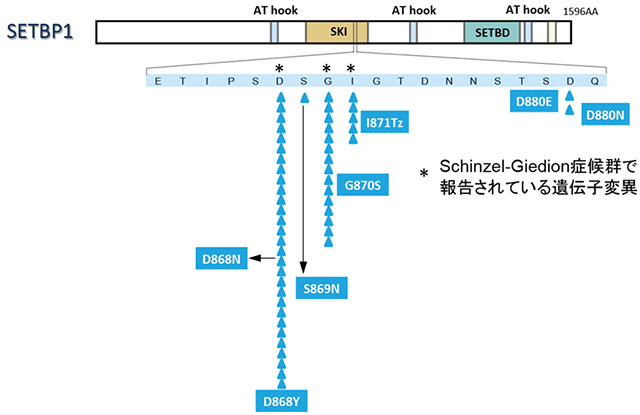
図2:727例の遺伝子変異解析によって同定されたSETBP1遺伝子変異
52症例でSETBP1遺伝子の変異が観察されたが、そのすべてがSKIホモローグドメインという部位に集中しており、また、Schinzel-Giedion症候群においても報告がある868番目、869番目、871番目のアミノ酸(*)に最も多く変異がみられた。
さらに、SETBP1遺伝子の変異を持った患者のMDSを発症時期に採取されたゲノムを用いて解析したところ、SETBP1遺伝子の変異はMDS発症時には認められないことがわかりました(図3)。したがって、SETBP1変異はMDSが進行して、最終的には白血病へと移行する過程で獲得されたことが明らかになりました。
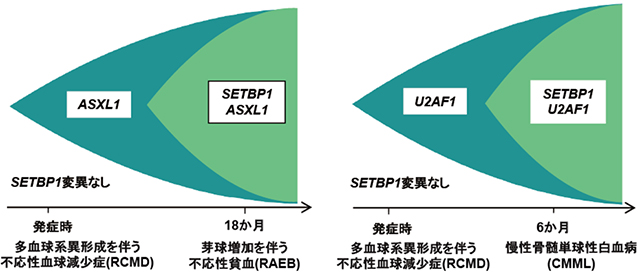
図3:MDSの進行に伴うSETBP1遺伝子変異の獲得
SETBP1変異はMDS発症時には認められず、MDSがより進行していくにしたがって獲得される変異であることが明らかになった。
SETBP1遺伝子の変異を持つMDS患者は生命予後が不良
SETBP1遺伝子の変異を持った症例と変異を持っていない症例の生命予後を比較検討したところ、SETBP1変異を持った症例ではSETBP1変異がない症例に比べて生命予後が悪いことが明らかになりました(図4左)。また、特に60歳以下のより若い患者ではSETBP1変異がある患者群では変異がない患者群に比べて生命予後が極めて悪いことがわかり、変異を有する症例には、骨髄移植など、積極的な治療の選択が必要である可能性があります。(図4右)。
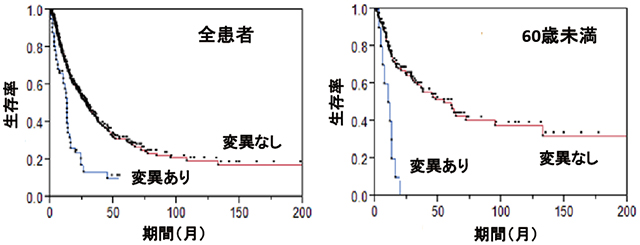
図4:SETBP1変異の有無による生命予後の違い
SETBP1変異を持つ症例では変異がない症例に比べて生命予後が不良であり(左)、特に60歳未満のより若い患者群では顕著な差が見られた。
SETBP1遺伝子の変異による白血病化
SETBP1遺伝子の変異が集中している部位はユビキチンリガーゼの結合する部位である可能性が高く、この場所に変異が起こるとユビキチンリガーゼがSETBP1に結合できなくなり、SETBP1蛋白が分解されずに蓄積して過剰発現することにより、白血病化につながるという仮説が立てられます。また、先行研究では、SETBP1を過剰に発現させるとマウスの造血幹細胞が不死化(細胞の分裂の回数に制限がない状態)することが報告されていました。今回MDSでみつかった変異型のSETBP1をマウスの造血幹細胞に発現させたところ、同様にマウスの造血幹細胞の不死化がみられました。この結果からも変異型のSETBP1遺伝子はSETBP1の過剰発現によって白血病化に関わっていると結論付けられました。
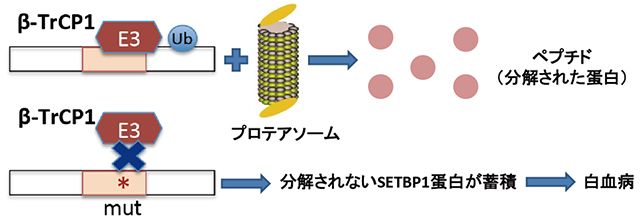
図5:SETBP1変異による白血病化のメカニズム
SETBP1遺伝子変異により、ユビキチンリガーゼがSETBP1に結合できなくなり、SETBP1蛋白が分解されずに蓄積し、白血病化につながる可能性が示唆された。
E3:E3ユビキチンリガーゼ、β-TrCP1:E3ユビキチンリガーゼの標的とする蛋白を認識する部位、mut:変異
今後の展開
今回の研究成果によって、SETBP1遺伝子の変異がMDSから白血病への進行に関わる重要な遺伝子変異であることがわかったことから、この変異をマーカーとしてこれまでより早期にMDSから白血病へ進行するハイリスクの患者を予測できるようになることが期待されます。また、SETBP1遺伝子変異は過剰発現によって白血病化をきたしている可能性が高いことから、SETBP1を治療標的とした新たな創薬に期待がもたれます。
本研究成果は、以下の研究事業によって得られたものです。
- 厚生労働省厚生労働科学研究費補助金 難治性疾患克服研究事業「不応性貧血の治癒率向上を目指した分子・免疫 病態研究」 研究代表者:小川誠司
- 文部科学省科学研究費補助金 新学術領域研究「システム的統合理解に基づくがんの先端的診断、治療、予防法の開発」 領域代表者:宮野悟、計画研究代表研究者:小川誠司
- 文部科学省科学研究費補助金 基盤研究A 研究課題名:「白血病幹細胞の維持と再発に関わる遺伝学的基盤の解明」 研究代表者:小川誠司
用語解説
生命予後
がんなどの疾患における余命などの命にかかわる予測
ゲノム
ある生物のもつ全ての遺伝情報、あるいはこれを保持するDNAの全塩基配列。タンパク質のアミノ酸配列をコードするコーディング(エクソン)領域とそれ以外のノンコーディング領域に大別される。
遺伝子変異
細胞の遺伝情報を担うゲノムDNAの配列の変化。がん細胞では、染色体全体の数が増加あるいは減少する大きな構造変化・染色体数の異常から、一塩基のみが変化する変異まで、多様な遺伝子の変異が認められる。
ユビキチンリガーゼ
ユビキチンリガーゼは標的となるタンパク質に結合し、これにユビキチンと呼ばれる小さなタンパク質を付加する(ユビキチン化)。ユビキチン化されたタンパク質はプロテオソームなどの働きにより、速やかに分解される。ユビキチン化とその後の分解の過程は、細胞内において不要になったタンパク質の除去や、タンパク質の量の調整に大変重要な役割を担っている。
書誌情報
[DOI] http://dx.doi.org/10.1038/ng.2696
Makishima Hideki, Yoshida Kenichi, Nguyen Nhu, Przychodzen Bartlomiej, Sanada Masashi, Okuno Yusuke, Ng Kwok Peng, Gudmundsson Kristbjorn O, Vishwakarma Bandana A, Jerez Andres, Gomez-Segui Ines, Takahashi Mariko, Shiraishi Yuichi, Nagata Yasunobu, Guinta Kathryn, Mori Hiraku, Sekeres Mikkael A, Chiba Kenichi, Tanaka Hiroko, Muramatsu Hideki, Sakaguchi
Hirotoshi, Paquette Ronald L, McDevitt Michael A, Kojima Seiji, Saunthararajah Yogen, Miyano Satoru, Shih Lee-Yung, Du Yang, Ogawa Seishi, Maciejewski Jaroslaw P.
Somatic SETBP1 mutations in myeloid malignancies.
Nature Genetics, 2013/07/07/online
- 朝日新聞(7月9日 28面)、京都新聞(7月27日 9面)、産経新聞(7月8日 22面)、中日新聞(7月8日 29面)、日刊工業新聞(7月8日 15面)、日本経済新聞(7月9日 14面)、読売新聞(7月14日 29面)および科学新聞(8月2日 2面)に掲載されました。

