2013年5月8日
木村郁夫 薬学研究科助教、井上大輔 同研究科大学院生、小澤健太郎 奈良県立医科大学准教授らの研究グループは、井上啓 金沢大学教授、今村武史 滋賀医科大学准教授らとの共同研究により、腸内細菌が産生する栄養(酢酸等の短鎖脂肪酸)を認識する脂肪酸受容体GPR43が脂肪の蓄積を抑制し、肥満を防ぐ機能を有することを明らかにしました。このことは腸内細菌や、短鎖脂肪酸の一種である酢酸が食事性の肥満防止に有効である可能性、さらにはこの短鎖脂肪酸受容体GPR43を標的とした肥満、糖尿病等の生活習慣病予防・治療薬への応用が期待されます。
本研究成果は、英科学誌「Nature Communications」電子版に2013年5月7日(英国時間)付けにて公開されました。
研究概要
エネルギー恒常性の維持は生命にとって非常に重要なものです。食事によるエネルギー摂取は日々のエネルギー利用のために重要であり、必要以上のエネルギーは脂肪として体内に蓄えられ、後のエネルギー不足時に有効利用されます。しかしながら、過度な食事による過剰エネルギー摂取は脂肪を必要以上に膨大させ、エネルギー恒常性維持の破綻とその結果として、肥満や糖尿病に代表される生活習慣病等の代謝疾患を引き起こします。
近年、腸内細菌がその宿主のエネルギー調節や栄養の摂取等のエネルギー恒常性維持に深く関与し、結果、肥満や糖尿病などの病態に影響するということが明らかになり、食事と腸内細菌そしてエネルギー恒常性への関係が非常に注目され始めました。食事時、腸内細菌によって産生される酢酸に代表される短鎖脂肪酸は主に宿主のエネルギー源として利用されます。しかしながら、本研究グループは以前に、この短鎖脂肪酸がエネルギー源としてのみではなく、体内のエネルギー状態の指標となり、脂肪酸受容体GPR41を活性化することにより交感神経系を介して、エネルギー恒常性の維持に関わることを明らかにしました(PNAS 2011)。今回の研究で本研究グループは、この短鎖脂肪酸のもう一つの受容体であるGPR43の脂肪組織における機能と腸内細菌によるGPR43を介した宿主へのエネルギー恒常性維持への関与について明らかにしました。
研究手法と成果
GPR43は脂肪組織に豊富に存在しており、そのGpr43遺伝子を欠損させたマウス(Gpr43KOマウス)は体重、脂肪重量の増加という肥満の傾向を示しました。さらに、本研究グループは脂肪組織におけるGPR43の機能の詳細な検討を行うために、このGPR43を脂肪組織特異的に過剰発現させたaP2-Gpr43トランスジェニックマウス(aP2-Gpr43TGマウス)を作製しました。結果、Gpr43KOマウスとは逆に痩せの傾向を示し、また、高脂肪食負荷による肥満型糖尿病の誘導に対し、aP2-Gpr43TGマウスは抵抗性を示しました。また、これらの変化がGPR43を活性化する短鎖脂肪酸の主要な産生源である腸内細菌が原因であるかどうかを確認するために、腸内細菌が全く存在しない無菌マウスや抗生物質処置により体内の腸内細菌叢を消失させたマウスを用いて実験を行ったところ、Gpr43KOマウス、aP2-Gpr43TGマウスともに、これらのエネルギー代謝異常が消失しました。さらに、このGPR43の脂肪組織直接的な機能として、筋肉や肝臓などの他のインスリン作用組織ではなく、脂肪組織でのインスリンの作用のみを選択的に抑制することがわかりました。すなわち、GPR43の活性化はブドウ糖や脂肪酸等のエネルギー源を脂肪組織に取り込んで脂肪として蓄積することを抑え、脂肪組織の増大のみを防ぐことで、結果的に体全体のインスリン感受性の上昇、エネルギー利用効率を上昇させることがわかりました。
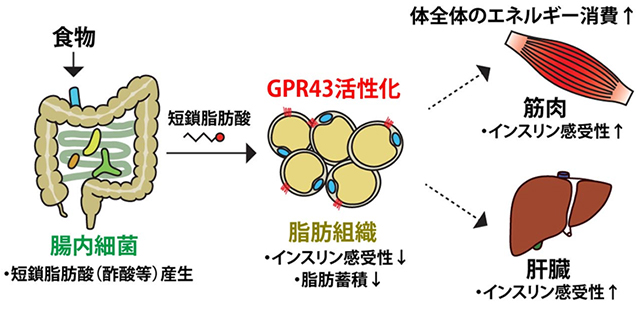
図1:過剰な食事性エネルギーに対するセンサーとしてのGPR43機能
したがって、腸内細菌の宿主に対する重要な機能として、
- 食事時、食物より直接得られるブドウ糖や脂肪酸などのエネルギー源と同時に、腸内細菌によって短鎖脂肪酸がエネルギー源として産生される。
- 通常はこの短鎖脂肪酸はエネルギー源としてだけ使用されるが、過度な食事により過剰エネルギーが得られた時に、同様に短鎖脂肪酸も過剰に上昇する。
- この過剰に上昇した短鎖脂肪酸を認識するセンサー受容体GPR43が活性化し、脂肪組織への過剰エネルギー蓄積を抑制し、エネルギー消費の方向へ誘導し、結果として過度な肥満から起こる代謝機能異常を防ぎ、また体全体のエネルギー消費を高め、体内のエネルギー恒常性の維持に働く。
ということを本研究グループは明らかにしました。
以上から、本研究グループは腸内細菌叢による宿主の恒常性維持に働く、全く新たなエネルギー調節機構を明らかにしました。さらにはこの短鎖脂肪酸受容体GPR43を標的とした肥満や糖尿病に代表される生活習慣病に対する予防・治療薬への応用が可能であると期待されます。
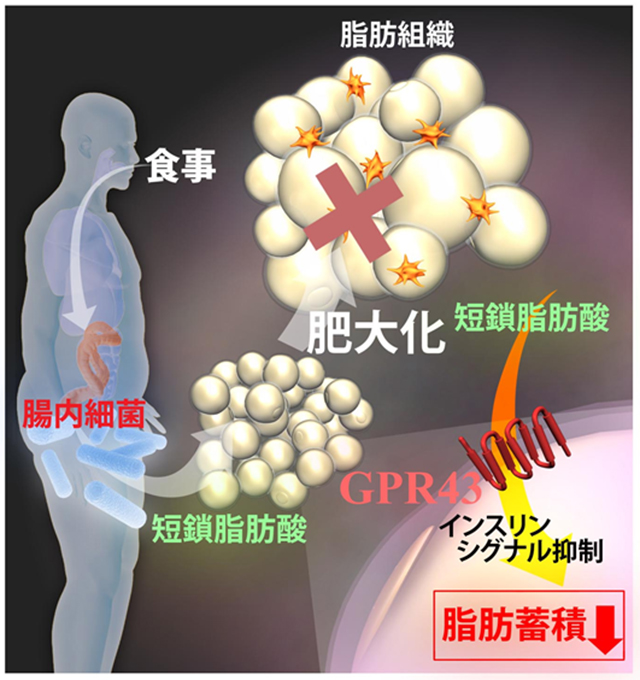
図2:GPR43活性化は脂肪の蓄積を抑え肥満を防ぐ
本研究成果は、以下の研究費によって得られました。
- 文部科学省 科学研究費補助金 若手(B)
- 文部科学省 科学研究費補助金 基盤(C)
- 科学技術振興機構(JST) 産学共同シーズイノベーション化事業「育成ステージ」
- ヤクルト・バイオサイエンス研究財団 特別課題研究助成
- 加藤記念バイオサイエンス振興財団 研究助成
- 稲盛財団 研究助成
書誌情報
[DOI] http://dx.doi.org/10.1038/ncomms2852
[KURENAIアクセスURL] http://hdl.handle.net/2433/173824
Ikuo Kimura*#, Kentaro Ozawa*, Daisuke Inoue*, Takeshi Imamura, Kumi Kimura, Takeshi Maeda, Kazuya Terasawa, Daiji Kashihara, Kanako Hirano, Taeko Tani, Tomoyuki Takahashi, Satoshi Miyauchi, Go Shioi, Hiroshi Inoue, and Gozoh Tsujimoto.
The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43.
* These authors contributed equally to this work, # Corresponding author
Nature Communications 4, Article number: 1829. 2013/05/07/online.
- 京都新聞(5月9日 24面)、産経新聞(5月9日 25面)および科学新聞(5月31日 4面)に掲載されました。

