2013年2月22日

左から近藤氏、井上准教授、岩田 長崎大学教授
近藤孝之 医学研究科大学院生(iPS細胞研究所(CiRA)リサーチアシスタント/科学技術振興機構(JST) CREST)、井上治久 CiRA准教授、岩田修永 長崎大学教授の研究グループは、山中伸弥 CiRA教授らの研究グループと協力し、複数のアルツハイマー病(AD)の患者さんごとに存在する病態を明らかにして、iPS細胞を用いた先制医療への道筋を示しました。
本研究成果は、2013年2月21日(米国東部時間)に米国科学誌「Cell Stem Cell」のオンライン版で公開されました。
要旨
本研究グループは、若年性(家族性)ADの原因遺伝子であるアミロイド前駆体タンパク質(APP)に遺伝子変異をもつ患者さんと、家族歴のない高齢発症(孤発性)ADの患者さんの皮膚からiPS細胞を作製し、大脳の神経系細胞に分化誘導させました。解析の結果、APP-E693Δと呼ばれる変異があると、アミロイドベータ(Aβ)というタンパク質がオリゴマーと呼ばれる凝集体となって細胞内に蓄積し、小胞体ストレスと酸化ストレスを引き起こし、細胞死を生じ易くすることがわかりました。また、ドコサヘキサエン酸(DHA)によって、これらの細胞内ストレスは軽減され、神経細胞死も抑制されました。さらに高齢発症の孤発性AD患者さんの中にもAPP-E693Δ変異と同様の細胞内Aβオリゴマーおよび細胞ストレスが見られるケースがあることがわかりました。
これらの研究結果は、iPS細胞技術応用は、疾患の病態解析や創薬研究にとどまらず、孤発性を含めた患者さんごとの病態を事前に把握し、適切な治療介入を行う「先制医療」に用いうることを示しています。
本論文のポイント
- アルツハイマー病患者さんのiPS細胞を用いて、若年発症および高齢発症どちらも共通に、アミロイドベータ(Aβ)という病気の原因物質が、細胞内に蓄積するタイプがあることを明らかにしました。
- 細胞内に蓄積したAβは凝集物(Aβオリゴマー)となり、細胞内ストレスを引き起こしましたが、Aβ産生阻害剤(BSI)もしくはDHA投与によりそのストレスは軽減しました。
- 本研究は、iPS細胞技術による、疾患の病態解明および創薬研究に加え、「病態を予め予測し、適切な治療を提供する先制医療」への道筋を示しました。
研究の背景
アルツハイマー病(AD)は、老年期認知症の中で最も多い疾患であり、その病理特徴としては、脳内に老人斑といわれるタンパク質の蓄積が見られます。この老人斑の主成分がAβであり、Aβの過剰な蓄積がアルツハイマー病の発症に深く関わっていると考えられていましたが、病態への関与の仕方は、ヒトの脳の細胞ではよく分かっていませんでした。
研究結果
アルツハイマー病患者さんからiPS細胞を作製し病態を再現
健常人(コントロール)3名と、APP-E693Δ変異もしくはAPP-V717L変異を持つ若年発症の家族性AD患者2名、さらに家族歴のない高齢発症の孤発性ADの方2名からiPS細胞を作製しました。
図1:本研究で作製したiPS細胞の位相差顕微鏡写真
そしてヒトiPS細胞から神経系細胞(大脳皮質神経細胞やアストロサイト)に分化誘導する技術を開発し、患者さんの神経系細胞群をin vitro(生体外)で作製しました。するとAPP-E693Δ変異を持つiPS細胞由来の神経系細胞で、細胞内にAβオリゴマーが蓄積し、小胞体ストレスを引き起こしていることがわかりました。さらに、マイクロアレイチップを用いた網羅的な遺伝子発現解析により、酸化ストレスに応答する遺伝子群の発現が増加していることが明らかになりました。また、活性酸素(reactive oxygen species : ROS)が増加していたことから、細胞内Aβオリゴマーを持つADの神経系細胞内部では細胞内酸化ストレスが引き起こされていますが、それに対して細胞が対抗措置を取り、細胞内環境を正常化しようとしていることが考えられました。
これらの細胞内ストレスはAβの合成阻害剤であるβセクレターゼ阻害薬(β-secretase inhibitor: BSI))によりAβを取り除くと改善されました。
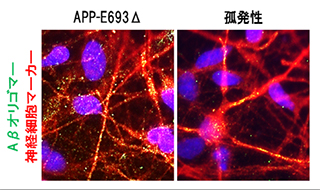
図2:神経細胞内に蓄積したAβの様子
緑色(または黄色)が蓄積したAβオリゴマー、青が細胞の核、赤が神経細胞を示す。コントロールの神経細胞ではAβオリゴマーは検出されない。
Aβによる細胞内のストレスは、適切な濃度のDHAで改善する
APP-E693Δ変異を持つiPS細胞由来の神経系細胞に対して、3種の化合物(活性酸素の生成阻害剤や小胞体ストレスを軽減する試薬など)を添加し、小胞体ストレスに対する治療効果を調べました。すると、低濃度のDHAを添加した時のみ、小胞体ストレスに応答するタンパク質(BiP、Caspase-4)や酸化ストレス(peroxiredoxin-4、活性酸素種)を減らしましたが、残り2種の化合物や高濃度のDHAでは逆に小胞体ストレスを増強してしまいました。さらに、低濃度のDHAを添加することで、APP-E693Δ変異を持つiPS細胞由来神経細胞の自然細胞死を、改善させることができました。この結果は、適切な有効濃度が存在することを示しています。
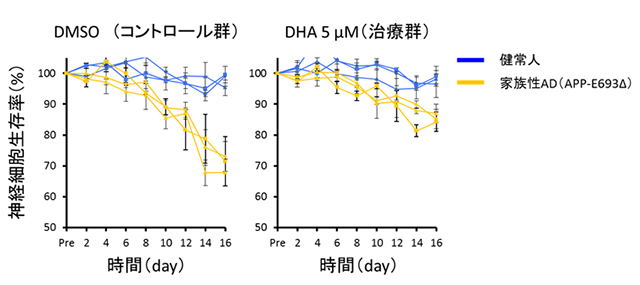
図3:iPS細胞から分化誘導した神経細胞の生存解析とDHAによる治療効果
健常人(青色線)ではiPS細胞から分化誘導した神経細胞の自然細胞死は見られなかったが、APP-E693Δ変異を持つ家族性AD(黄色線)では、2週間程度の培養で細胞死が見られた。適切な量のDHAを添加して培養すると、細胞死が改善された。
一部の孤発性ADにおいても細胞内Aβオリゴマーと細胞ストレスが観察された
若年発症型の家族性ADのみでなく、家族歴のない高齢発症の孤発性ADの患者さんにおいても解析を進めると、1名においてはAPP-E693Δ変異と同様に細胞内Aβ蓄積や細胞ストレスが見られ、低濃度DHAで細胞ストレスを除去することができました。
この結果は、DHAによる処置が有効であるアルツハイマー病の集団と有効でない集団が存在する可能性を示しています。つまり、一見同じに見えるADも、背景にひそむ病態は多様であり、病態特性に応じた治療戦略が必要であるということです。そして、iPS細胞技術による疾患を先制的に治療制御する医療への道筋を提示しています。
まとめ
本研究では、若年発症型および高齢発症の孤発性アルツハイマー病患者さんの神経細胞・アストロサイト内にAβオリゴマーが蓄積し、種々の細胞ストレスを引き起こしているケースがあることを明らかにしました。
より表現型の強い若年発症型アルツハイマー病患者さんのiPS細胞を用いて、病態解析や創薬研究のプラットフォームを開発し、孤発性アルツハイマー病患者さんのiPS細胞をそのプラットフォーム上で解析することで、患者さんの大部分を占める孤発性アルツハイマー病治療開発を推進する新たな方向性を示しました。
これらの成果を推し進めることで、従来の均一な疾患概念に対する画一的な治療を超えて、先制的な病態診断に基づき適切な治療を行う「先制医療」の開発が今後の課題であり、そのためには、iPS細胞技術のさらなる進展が必要であると考えられます。
本研究は、下記機関より資金的支援を受けて実施されました。
- 科学技術振興機構(JST) CREST
- JST山中iPS細胞特別プロジェクト
- 内閣府「最先端研究開発支援プログラム(FIRST)」
- 文部科学省科学研究費補助金 新学術領域研究「シナプス病態」
- 厚生労働科学研究費補助金(iPS細胞を利用した創薬研究支援事業)
- 厚生労働科学研究費補助金(難治性疾患克服研究事業 疾患特異的iPS細胞を用いた難治性疾患の画期的診断・治療法の開発に関する研究)
- 厚生労働科学研究費補助金(障害者対策総合研究事業(神経・筋疾患分野))
- 臨床薬理研究振興財団研究基金
書誌情報
[DOI] http://dx.doi.org/10.1016/j.stem.2013.01.009
論文名
"Modeling Alzheimer's Disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness"
ジャーナル名
Cell Stem Cell
著者
Takayuki Kondo,1,2,7 Masashi Asai,7,9,10 Kayoko Tsukita,1,7 Yumiko Kutoku,11 Yutaka Ohsawa,11 Yoshihide Sunada,11 Keiko Imamura,1 Naohiro Egawa,1 Naoki Yahata,1 Keisuke Okita,1 Kazutoshi Takahashi,1 Isao Asaka,1 Takashi Aoi,1 Akira Watanabe,1 Kaori Watanabe,7,10 Chie Kadoya,7,10 Rie Nakano,7,10 Dai Watanabe,3 Kei Maruyama,9 Osamu Hori,12 Satoshi Hibino,13 Tominari Choshi,13 Tatsutoshi Nakahata,1 Hiroyuki Hioki,4 Takeshi Kaneko,4 Motoko Naitoh,5 Katsuhiro Yoshikawa,5 Satoko Yamawaki,5 Shigehiko Suzuki,5 Ryuji Hata,14 Shu-ichi Ueno,15 Tsuneyoshi Seki,16 Kazuhiro Kobayashi,16 Tatsushi Toda,16 Kazuma Murakami,6 Kazuhiro Irie,6 William L. Klein,17 Hiroshi Mori,18 Takashi Asada,19 Ryosuke Takahashi,2 Nobuhisa Iwata,7,10,* Shinya Yamanaka,1,8 and Haruhisa Inoue1,7,8,*
(* 責任著者)
著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科脳病態生理学講座臨床神経学(神経内科)
- 京都大学大学院医学研究科生体情報科学
京都大学大学院生命科学研究科認知情報学 - 京都大学大学院医学研究科高次脳形態学
- 京都大学大学院医学研究科形成外科
- 京都大学大学院農学研究科食品生物科学専攻
- 科学技術振興機構(JST) CREST
- 科学技術振興機構(JST) 山中iPS細胞特別プロジェクト
- 埼玉医科大学医学部
- 長崎大学薬学部
- 川崎医科大学
- 金沢大学大学院医学研究科
- 福山大学薬学部
- 愛媛大学大学院医学研究科機能組織学
- 愛媛大学大学院医学研究科精神科
- 神戸大学大学院医学研究科
- ノースウェスタン大学(USA)
- 大阪市立大学大学院医学研究科
- 筑波大学大学院人間総合科学研究科(臨床医学系)
- 朝日新聞(2月22日 37面)、京都新聞(2月22日 1面)、産経新聞(2月22日 2面)、日刊工業新聞(2月22日 24面)、日本経済新聞(2月22日 42面)、毎日新聞(2月22日 2面)および読売新聞(2月22日 1面)に掲載されました。

