2010年11月25日
鈴木淳 医学研究科(医化学分野)助教、長田重一 同教授のグループは、血小板が血液凝固をスタートさせるのに必要な膜蛋白質を同定しました。血液凝固が効率よくおこらないヒトの原因不明の病気 (Scott Syndrome、スコット症候群)の患者ではこの蛋白質を産生できなくなっていました。
この研究成果は、2010年11月24日18時(ロンドン時間)英国科学雑誌「Nature」のon line 版に発表されました。
研究の概要
動物細胞の細胞膜は二重膜を形成しているが、外側と内側では同一ではない。リン脂質フォスファチジルセリン (PS) やフォスファチジルエタノールアミン (PE) は膜の内側にのみ存在するのに対し、フォスファチジルコリン(PC)は比較的外膜に多い。この膜の非対称性は種々の局面で破綻する。例えば、細胞がアポトーシス (細胞死)に陥ると死細胞の表面にはPSが暴露され、これをマクロファージが“eat me”シグナルと認識、死細胞を貪食する。一方、止血反応において出血した血管内皮に結合した血小板は破壊された内皮細胞から放出された分子により活性化され、PSを暴露する。そして、このPSを介して凝固因子(Factor VIII, Factor V, Factor Xなど)が活性化され、血液凝固反応が進行する。このように、細胞膜におけるリン脂質の非対称性の崩壊は生体の種々の過程で重要な役割を果たしている。それにも関わらず、どのような機構で膜の非対称性が破綻するかその分子機構は殆ど解明されていない。
リン脂質の非対称性を誘導する因子はスクランブラーゼ(Scramblase)と呼ばれ、カルシウム(Ca)によって活性化されると考えられていたが、その実体は明らかでなかった。細胞内のCa濃度(100 nM) は細胞外(数mM)に比べて1万分の1以下である。鈴木助教は膜にカルシウムを透過させる薬剤 (Ca-ionophore) でマウスB-リンパ球株(Ba/F3)を処理すると、PSが細胞膜上に暴露されること、この際、培養液中にCaが存在すると細胞は急速に死滅するが、Caが存在しないと細胞は死滅しないことを見いだした。細胞外にCa が存在すると高濃度のCaが細胞内に流入、細胞を殺したと考えられる。一方、細胞外にCaが存在しないと、Ca-ionophoreは小胞体の膜に作用し、小胞体内に蓄積されていたCa (数100 μM )を細胞質に流入させ、スクランブラーゼを活性化させたと考えられる。このような条件下で暴露されたPSはCa-ionophoreを除くと時間とともに減少した。
鈴木助教は、細胞をCa非存在化でCa-ionophoreで処理するとPSが一過的に暴露される特徴を用いて、PSをよく暴露する細胞を樹立した。すなわち、Ca非存在化でBa/F3をCa-ionophoreで処理、PSを最もよく暴露した細胞 (全体の1−2%) をFACS(Fluorescence-activated cell sorting) 法により分別、収集した。この細胞を培養、増殖させ、再びCa-ionophoreで処理、1-2%の分画を採集する。この操作を19回繰り返した。その結果、親株であるBa/F3細胞より100倍以上強くPSを暴露する細胞株が樹立された。次いでこの細胞株から動物発現ベクターを用いてcDNAライブラリーを構築、 これをBa/F3細胞株に導入しPSの暴露に関与する遺伝子を同定した。
単離されたcDNAは、TMEM16Fと呼ばれる8個の膜貫通領域を持つ膜蛋白質に1個のアミノ酸置換が導入された変異蛋白質をコードしていた (図1)。このcDNAを発現させたBa/F3細胞は構成的にPSを暴露した。一方、野生型のTMEM16FをBa/F3細胞に発現させ、Caで刺激するとその細胞は親株に比べ急速にPSを細胞外に暴露した。また、shRNA(small hairpin RNA) 法によりBa/F3細胞で発現されているTMEM16F mRNA量を減少させると、Caに応答したPSの暴露は顕著に抑制された。Scramblaseは、PSばかりでなく、他のリン脂質の外膜、内膜の移動も促進するとされている。実際、変異型TMEM16Fを発現するBa/F3細胞は本来外側にあるべきPEを構成的に細胞外に暴露し、また通常は外膜に大部分存在するPCを内膜へと移動させた。また野生型のTMEM16Fを発現する細胞ではこれらリン脂質の移動が顕著に促進され、shRNAによりTMEM16Fの発現が減少した細胞ではリン脂質の移動が抑制された。以上より、TMEM16FはCaに依存してリン脂質を内膜、外膜の間でスクランブルさせる因子、スクランブラーゼと結論した。
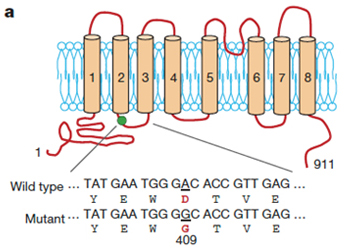
- 図1 Scramblase TMEM16Fの構造
第X血液凝固因子やトロンビンが活性化されず、血液凝固が効率よく進まないスコット症候群(Scott Syndrome)と呼ばれる病気が知られている。この患者さんの血小板や赤血球、B-リンパ球をCaで刺激してもPSが細胞外に暴露されないことからスクランブラーゼに欠損があると考えられた。1994年、アメリカ・ウイスコンシン Sims 博士の研究室に留学していた小島寛博士(現 茨城県立中央病院・腫瘍内科)はこの患者さん、および患者さんの両親から調製したリンパ球をウイルスを用いて不死化し、細胞株を樹立した。その細胞株がPeter J. Sims博士(現在Rochester University Medical Schoolの教授)の研究室に保管されていたことから、これらの細胞を京都大学に送っていただき、鈴木助教はこれら細胞におけるTMEM16F 遺伝子、TMEM16F mRNAを解析した。TMEM16F遺伝子は20個のエクソンから成り立っている。患者さんのTMEM16F mRNAでは13番目のエクソンが欠質、そのためこの蛋白質は分子のほぼ半ばで途切れていた (図2)。mRNAの前駆体からmRNA が産生される際、残すべきエクソンは“AG----GT”の配列で囲まれている。スコット症候群の患者さんのTMEM16F 遺伝子ではエクソン13の5’側においてAGであるべき配列がATに変異していた。そのため、エクソン13はスキップされ、エクソン12はエクソン14に直接、結合した。その結果、mRNA上での蛋白合成のフレームがずれ、蛋白質への翻訳はエクソン14上で終結、ほぼ半分の大きさの蛋白質しかできなくなっていた。患者さんの両親はこの変異を持つ遺伝子と正常な遺伝子を1個ずつもつが、患者さんは2個の遺伝子とも変異型であり、このためスクランブラーゼが欠損、血小板はPSを暴露できないと考えられる。
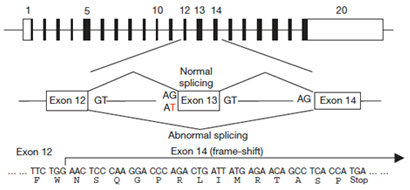
- 図2. スコット 症候群の患者に見いだされたTMEM16F遺伝子の変異
今回、私達は血小板が血液凝固を開始する際のシグナル、PSの細胞表面への暴露を引き起こす因子 (TMEM16F) を同定した。そして、スコット症候群の一人の患者さんにおいて、この遺伝子に変異があることを見いだした。今後はスコット症候群の他の患者もTMEM16F遺伝子に変異が存在するか、血液凝固に欠陥を持つ患者でこの因子の変異で説明できる患者が存在するか検討する必要があろう。また、今後、TMEM16Fの活性を促進あるいは抑制する薬剤が開発できれば、これらは血液凝固の促進、あるいは血栓形成阻止の薬として使われる可能性もあろう。最後に、細胞膜の非対称性の破綻、PSの暴露は死細胞の貪食、筋肉細胞や骨芽細胞の成熟過程にも関与している。今回の成果は今後これらの過程を理解する上でも役立つであろう。
共同研究者
鈴木淳 京都大学大学院医学研究科 分子生体統御学 医化学分野 助教
梅田真郷 京都大学大学院工学研究科 合成・生物化学専攻 教授
Dr. Peter J. Sims, Professor, Dept. of Pathology & Laboratory Medicine, University of Rochester Medical Center (ロチェスター大学医学部 病理学教室教授)
長田重一 京都大学大学院医学研究科 分子生体統御学 医化学分野 教授
今回の成果は日本学術振興会科学研究費 特別推進研究「マクロファージによる死細胞貪食・分解の分子機構」および科学技術事業団戦略的創造研究推進事業 (CREST) 研究領域「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」 (菅村和夫領域代表)の研究推進過程で得られたものである。
関連リンク
- 以下は論文の詳しい書誌情報です。
Suzuki J, Umeda M, Sims PJ, Nagata S. Calcium-dependent phospholipid scrambling by TMEM16F [Internet]. Nature 2010 Nov;advance online publication Available from:
http://dx.doi.org/10.1038/nature09583 - http://hdl.handle.net/2433/131831(京都大学学術情報リポジトリ(KURENAI))
- 朝日新聞(11月30日 22面)、京都新聞(11月25日 23面)、日刊工業新聞(11月25日 31面)、毎日新聞(11月25日 2面)および読売新聞(11月25日 2面)に掲載されました。

