2010年9月30日

左から白川助教、金子教授
金子周司 薬学研究科教授、白川久志 薬学研究科助教らの研究グループの研究成果が「Journal of Neuroscience」誌(米国)に掲載されました。
- 論文名:
TRPC3 MEDIATES THROMBIN-INDUCED ASTROCYTE ACTIVATION AND UPREGULATES ITS OWN EXPRESSION IN RAT CORTICAL ASTROCYTES
TRPC3は自身のタンパク発現量を増大させることにより、トロンビンによるアストロサイトの異常活性化を媒介する。
Hisashi Shirakawa, * Shinya Sakimoto,* Kenji Nakao,* Aiko Sugishita, Masakazu Konno, Syota Iida, Ayaka Kusano, Emina Hashimoto, Takayuki Nakagawa and Shuji Kaneko *These authors contributed equally to this work.
白川久志、﨑元伸哉、中尾賢治、杉下亜維子、金野真和、飯田将太、草野綾香、橋本恵美奈、中川貴之、金子周司
The Journal of Neuroscience (ジャーナルオブニューロサイエンス) 30巻: 13116-13129ページ, 2010年(2010年9月29日号)
研究成果の概要
脳出血や脳梗塞などの脳血管疾患(一般的には脳卒中とも言われます)が起こった時には、脳の血管が破れ、そこから漏れ出した血中由来因子が脳細胞に病理的な変化を引き起こします。そのような血中由来因子の中で最も重要な因子の一つとして、末梢では血液の凝固に関与する酵素であるトロンビンがあげられます。トロンビンは、脳の中で最も数の多い細胞であるアストロサイト(グリア細胞の一種です)に作用して、細胞形態変化や異常増殖を伴ったグリオーシス(神経膠症)を引き起こすことが知られています。このグリオーシスは時として、脳血管疾患の病態を悪化させる因子の放出に至ったり、予後の神経系の回復を物理的に妨げたりして、一般的に治療の邪魔をする存在となりますが、その分子メカニズムには不明な点が多く残されてきました。
今回私達は、TRPC3(トリップ シー3)という細胞膜に存在して、カルシウムを透過させるイオンチャネルの働きに着目しました。ラットの脳から調製した培養アストロサイトにトロンビンを作用させるとTRPC3のタンパク量が増大しましたが(図1)、この増大はTRPC3の特異的な阻害薬を併用させることで完全に抑制されたことから、アストロサイトにはTRPC3の自己活性に依存して発現量を増幅させる機構があることがわかりました。さらにトロンビンをアストロサイトに作用させると、脳血管疾患の病態時に見られるような細胞形態の変化が起こったり、S100Bという過剰に放出されるタンパク質の発現量が増大したり、過剰増殖が起こったりしましたが、RNA干渉という手法を用いてTRPC3の発現量を特異的に抑制したアストロサイトでは、トロンビンによるそれら全ての病理的変化が起こらなくなりました(図2)。
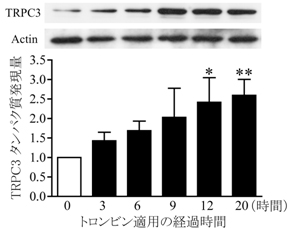
- 図1: アストロサイトにおけるトロンビン誘発TRPC3タンパク発現量増大の時間依存性。トロンビンを12時間以上作用させることでTRPC3のタンパク発現量が増大した。この作用はmRNA増大を定量化した結果においても同様であった。
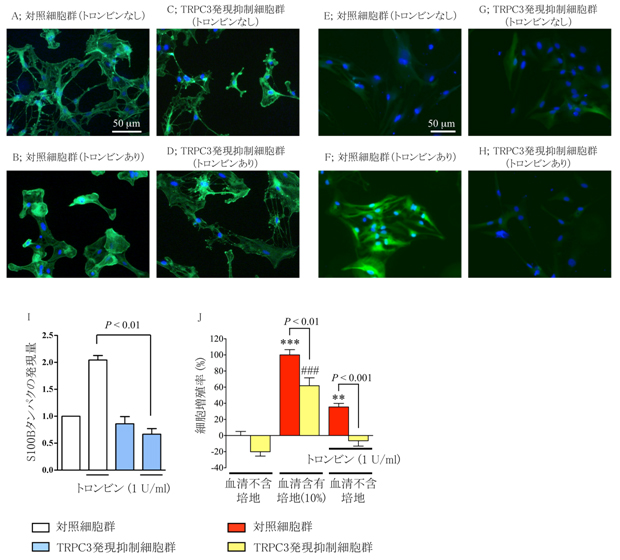
- 図2: TRPC3の発現を特異的に抑制したアストロサイトではトロンビンによる病理的変化が起きなくなる。
A-D) アストロサイトの形態変化の検討。Aと比較してトロンビンを作用させたBでは細胞が丸くなり、突起がなくなっているが、TRPC3発現を抑制したCとDの写真の細胞ではそのような変化は起きなかった。
E-I) アストロサイトのS100Bタンパク発現量増大の検討。Eと比較してトロンビンを作用させたFではS100B発現量が増え、蛍光強度が強くなっているが、TRPC3発現を抑制したGとHの写真の細胞ではそのような変化は起きなかった(Iのグラフにまとめられている)。
J) アストロサイトの過剰増殖の検討。TRPC3発現を抑制した細胞ではトロンビンによる細胞増殖率の増大はほとんど起きなかった。
次にマウスの脳内にトロンビン受容体の作動薬を注入すると、アストロサイトが過剰に増殖していましたが、それら増加したアストロサイトの大部分は新たにTRPC3を発現するようになっていました(図3)。以上の結果から、アストロサイトにトロンビンを作用させると細胞膜にあるイオンチャネルであるTRPC3が自身の発現量を増大させながらアストロサイトを異常な活性化の方向へと導くことが新たに判りました(図4)。
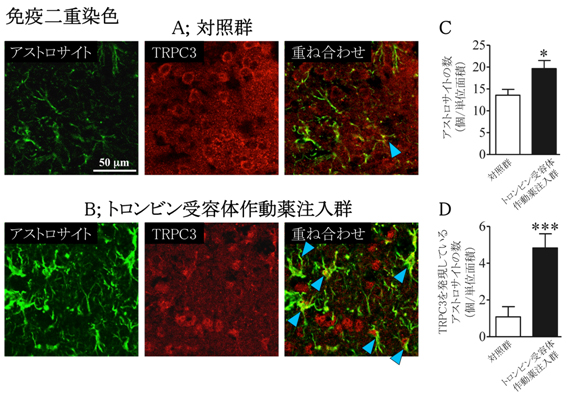
- 図3: マウス脳内へトロンビン受容体作動薬(SFLLR-NH2)を注入すると、TRPC3発現増大を伴うグリオーシスが起こる。AとBの写真を比較すると、アストロサイトの数が増えているが(Cのグラフにまとめられている)、その増加したアストロサイトの大部分はTRPC3を発現するようになっていた(Dのグラフにまとめられている)。
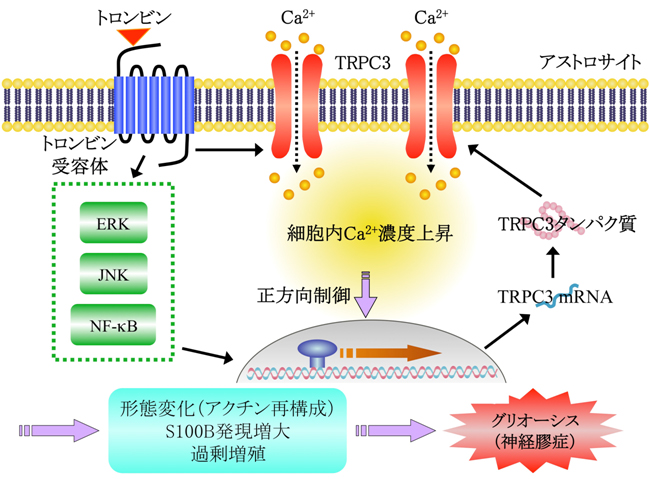
- 図4: アストロサイトにトロンビンを作用させると、細胞膜にあるイオンチャネルであるTRPC3が自身の発現量を増大させながら働き、アストロサイトを神経膠症(グリオーシス)など異常な活性化の方向へ導く。
このTRPC3の働きを抑える薬物は、アストロサイトの異常活性化を抑えることで、脳血管疾患発症後の神経機能回復過程における薬物治療に役立つ可能性があると考えられます。また、アストロサイトの異常な活性化が関与すると想定されている脳神経系の病気は、脳血管疾患の他にも、アルツハイマー病、パーキンソン病、多発性硬化症、脊髄損傷、神経障害性疼痛など多数知られていることから、これらの疾患においてもアストロサイトのTRPC3の働きを抑える薬物が、病気の進行を抑制するか否かについては、検討すべき興味深い課題と考えられます。
関連リンク
- 論文は、以下に掲載されております。
http://dx.doi.org/10.1523/JNEUROSCI.1890-10.2010
- 京都新聞(10月1日 27面)および日刊工業新聞(10月1日 24面)に掲載されました。

