2009年7月10日
京都大学
慶應義塾大学
人工多能性幹細胞(iPS細胞)は、体細胞に多能性誘導因子を導入することで樹立され、神経、心筋細胞などに分化する多能性を持ちます。免疫拒絶や倫理的な問題が回避されると考えられ、将来、細胞移植治療などの再生医療への応用が期待されています。しかし、それに先立ち、iPS細胞の治療効果はもとより、安全性についての厳格な評価が必要です。
山中伸弥 京都大学物質-細胞統合システム拠点iPS細胞研究センター/同再生医科学研究所教授らと岡野栄之 慶應義塾大学医学部教授らの共同研究グループは、体細胞の由来や樹立法が異なる、様々なマウスiPS細胞から神経系前駆細胞を分化誘導し、マウス脳へ移植する試験を行いました。その結果、iPS細胞の樹立に用いた体細胞の由来が移植安全性に大きく影響することをこの度、見出しました。
本研究では、胎仔マウス由来線維芽細胞や、成体マウスの尾部由来線維芽細胞、肝細胞、胃上皮細胞に、4遺伝子(Oct3/4, Klf4, Sox2, c-Myc)またはc-Myc(山中伸弥教授らの研究グループによるとc-Mycの再活性化が腫瘍形成の一因と確認されている)を除く3遺伝子を導入、細胞選抜作業の有無の条件下、iPS細胞を樹立しました。これらのiPS細胞からニューロスフェアとして分化誘導された神経系前駆細胞を免疫不全マウスの脳に移植しました。その結果、胎仔マウス線維芽細胞や成体胃上皮細胞から樹立されたiPS細胞由来のニューロスフェアを移植したマウスには、ほとんど腫瘍が見られませんでした。これは、ES細胞を用いて同様の試験を行って得られた結果と同等であると考えられました。一方、成体マウス尾部由来線維芽細胞から作られたiPS細胞からのニューロスフェアの場合、移植されたマウスの多くで腫瘍が形成されました。肝細胞由来のiPS細胞においても一部において腫瘍が形成されました。神経系へ分化誘導をしても未分化細胞が残存したため、腫瘍が形成されたと考えられ、また組織学的解析から、この腫瘍は奇形腫ないし奇形癌腫と考えられました。上記の結果は、iPS細胞樹立に用いた因子でのc-Mycの有無や、細胞選抜作業の有無との関連性はありませんでした。また、キメラマウスでの腫瘍発症の要因であるc-Myc遺伝子の活性化は、移植試験に用いたiPS細胞にはみられず、奇形腫形成には関与していないことが確かめられました。
今回、36種類のマウスiPS細胞を評価しましたが、これほどの規模で同時に安全性を評価した事例は世界で初めてです。この成果は、今後の再生医療への応用へ向けた、ヒトiPS細胞の安全性の確保に向けて、iPS細胞樹立に用いる体細胞の重要性を示すとともに、数多くのiPS細胞株の中から移植安全性に優れた株を評価、選抜する方法の重要性と方向性を明示すものと期待されます。
京都大学と慶應義塾大学による本共同研究は、文部科学省「再生医療の実現化プロジェクト」および、両大学が2007年に締結した「連携協力に関する基本協定書」に基づく医学・生命科学分野における連携プロジェクトの一環によるものであり、また、下記「本研究への支援」に記述している機関の支援を受け実施されました。
今回の研究成果は、7月9日(木曜日)午後3時(米国東部時間)に英科学誌Nature Biotechnologyのオンライン速報版で発表されました。
論文名:
- "Variation in the safety of induced pluripotent stem cell lines"
「安全性におけるiPS細胞株の多様性」
Kyoko Miura, Yohei Okada, Takashi Aoi, Aki Okada, Kazutoshi Takahashi, Keisuke Okita, Masato Nakagawa, Michiyo Koyanagi, Koji Tanabe, Mari Ohnuki, Daisuke Ogawa, Eiji Ikeda, Hideyuki Okano, and Shinya Yamanaka
研究の背景
iPS細胞は、2006年に山中伸弥教授らの研究グループがマウスの線維芽細胞に4転写因子(Oct3/4, Klf4, Sox2, c-Myc)をレトロウイルスベクターで導入することにより、世界で初めて樹立されました。同様に2007年には、ヒトiPS細胞の樹立にも成功しています。iPS細胞は、ES細胞(胚性幹細胞)に似た形態、遺伝子発現様式をもち、また、高い増殖能性と様々な組織の細胞に分化できる多能性を併せ持ちます。採取に差し支えない組織細胞から樹立できるiPS細胞は、ES細胞が直面する倫理的問題や移植後免疫拒絶を回避し、細胞移植治療への応用が期待されています。
しかし、マウスiPS細胞から作製したキメラマウスやその子孫では、導入されたc-Myc遺伝子の再活性化により、腫瘍を発症することが確認されています。そこで、c-Myc遺伝子を除く3因子のみを用いてiPS細胞を樹立しました。このiPS細胞由来のキメラマウスでは、腫瘍形成は著しく低下しましたが、樹立効率も低下しました。
昨今、世界中の研究者が、様々な種類の因子や体細胞を用いてiPS細胞を樹立したことを報告しています。このように様々な樹立方法が存在することを考えると、iPS細胞を用いた再生医療応用を実現するためには、個別のiPS細胞株の安全性を厳格に評価する方法を開発することが重要になってきました。
研究成果
本研究では、様々な種類のマウスiPS細胞株を神経系前駆細胞に分化誘導させ、移植安全性を評価することに成功しました。
まず、36種類のマウスiPS細胞株を2次ニューロスフェア(以下、SNS)に分化させて、免疫不全マウスの脳内に移植し、腫瘍形成を主指標にして安全性を検証しました。これらのiPS細胞は下記の(1)~(3)の条件の組み合わせで、樹立しました。
| (1) | iPS細胞樹立に用いた体細胞の種類 胎仔マウス線維芽細胞(mouse embryonic fibrobrasts, 以下MEF) 成体マウス尾部線維芽細胞(tail tip fibroblasts, 以下TTF) 肝細胞(hepatocytes, 以下Hep) 胃上皮細胞(gastric epithelial cells, 以下Stm) |
| (2) | iPS細胞樹立に用いる因子におけるc-Myc遺伝子の有無 |
| (3) | Nanog(細胞の分化多能性に重要な働きをする遺伝子)発現を指標にした細胞選抜作業の有無 また、コントロールとして、3種類のES細胞株を用いました。 |
結果(1) iPS細胞からSNSへの分化誘導能について
36種類のマウスiPS細胞株のうち、3株のHep-iPS細胞、1株のStm-iPS細胞はin vitro(体外)でSNSに分化できませんでした。しかし、その他の分化誘導されたSNSは、3種の神経系細胞(神経細胞、アストログリア、オリゴデンドログリア)にin vitroで分化しました。これらのSNSは、in vivo(体内)でも同様に分化しました。これらのiPS細胞は、c-Mycの導入の有無、細胞選抜の有無にかかわらず、ES細胞に匹敵する神経系への分化能を有することを確認しました。
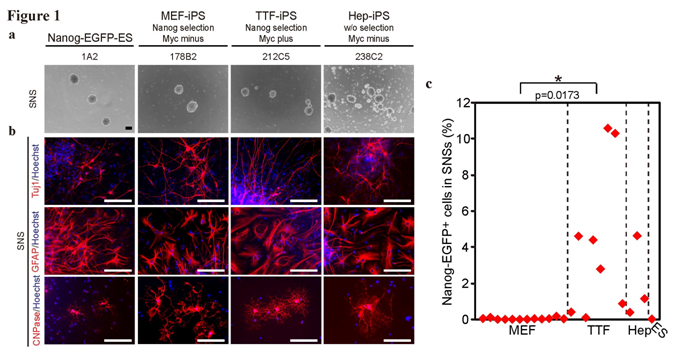
図1.体細胞由来iPSからSNSへの分化
a. 様々な体細胞由来のiPS細胞(左から:ES細胞, MEF-iPS, TTF-iPS, Hep-iPS)から分化誘導されたSNSの写真
b. SNSから分化した(上から)神経細胞、アストログリア、オリゴデンドログリアの写真
c. 体細胞由来別iPS細胞から分化誘導されたSNSの未分化細胞混入率
結果(2) SNS内の未分化細胞の混入率について
次に、分化誘導されたSNSにどの程度の未分化細胞が混入しているか、フローサイトメトリーで調べたところ、MEF-iPS細胞由来のSNSでは、未分化細胞の混入はほとんど見られませんでした(0-0.38%)。この結果は、ES細胞由来SNSの場合に匹敵する数値でした。一方、TTF-iPS細胞由来SNSの未分化細胞混入率は、著しく高い数値を示しました(0.025-20.1%)。Hep-iPS細胞由来のSNSも高い未分化細胞混入率を示しました(0.034-12.0%)。c-Myc導入の有無、細胞選抜の有無は、いずれもSNSの未分化細胞混入率に影響しないことを確認しました。
結果(3) SNS移植後のマウス脳におけるテラトーマ(奇形腫)発生について
In vivoで検証するために、SNSを免疫不全マウスの脳の線条体に移植し、移植後、マウスが死亡、あるいは衰弱時に、脳を解剖しました。健康なマウスについては、移植後4週間から45週間以内に解剖しました。結果は、下記の通りでした。
- ES細胞由来SNS
ES細胞3株由来のSNSが移植された34匹のマウスのうち、腫瘍により3匹が死亡、または衰弱しました。残りの31匹には、1匹に小さな腫瘍が確認されましたが、30匹には腫瘍は発見されませんでした。 - MEF-iPS細胞由来SNS
ES細胞由来SNS移植時と同等の結果が得られました。MEF-iPS細胞12株由来のSNSを移植された100匹のうち、9匹が移植後19週間以内に死亡または衰弱しました。内8匹には腫瘍が確認されました。残りのマウスを解剖したところ、66匹は腫瘍を形成しませんでしたが、25匹には様々な大きさの腫瘍が確認できました。 - TTF-iPS細胞由来SNS
TTF-iPS細胞11株由来のSNSを移植された55匹のうち、46匹が移植後9週間以内に腫瘍のために死亡または衰弱しました。9匹の健康なマウスには腫瘍が見られませんでした。 - Hep-iPS細胞由来SNS
Hep-iPS細胞7株由来のSNSを移植された36匹のうち、13匹が移植後17週間以内に死亡または衰弱しました。内10匹が腫瘍を発生していました。健康な23匹を切開したところ、腫瘍は見られませんでした。 - Stm-iPS細胞クローン由来
Stm-iPS細胞2株由来のSNSを移植された8匹を、移植16週間後に解剖したところ、腫瘍は確認されませんでした。
検出された腫瘍を組織学的に分析したところ、横紋筋、導管状上皮細胞、ケラチン性上皮細胞、軟骨、神経細胞などの様々な種類の三胚葉の細胞が確認できました。また、腫瘍には大量の未分化細胞も含まれていました。このことから、これらの腫瘍は、悪性腫瘍ではなく、奇形腫と考えられます。また、腫瘍の発生していない脳を解剖したところ、移植された細胞が生着していました。
統計的分析によると、TTF-iPS細胞由来のSNSは、その他のiPS細胞由来SNSと比べて、著しく大きい腫瘍を形成しました。加えて、TTF-iPS細胞、Hep-iPS細胞由来のSNSは、死亡、衰弱の発生に関して有意に高率でした。iPS細胞樹立におけるc-Myc使用の有無、細胞選抜工程の有無は、腫瘍の大きさや、死亡、衰弱の発生について、あまり関連性がないことが確認されました。
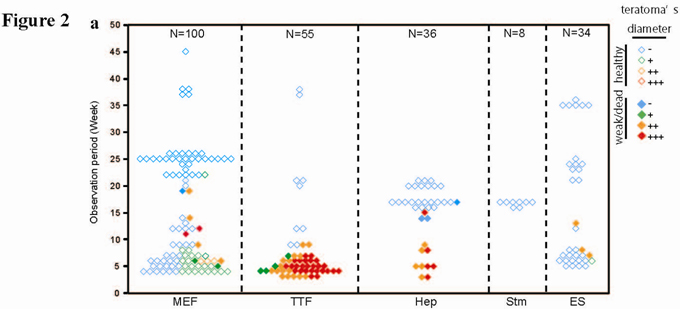
図2.SNS移植後のマウス脳におけるテラトーマ発生状況
MEF-iPS、TTF-iPS、Hep-iPS、Stm-iPS、ES細胞由来のSNSを免疫不全マウス脳に移植し、テラトーマ形成を検証した。図は、それぞれのカテゴリーで、死亡、衰弱したマウス、および、健康なマウスの解剖時期を示している。オープンマークは健康なマウス、塗りつぶされているマークは死亡、衰弱したマウス。
青:テラトーマ形成が確認されなかった、緑:テラトーマ直径 0.1-5.7 mm
オレンジ:テラトーマ直径 5.8-8.2 mm、赤:テラトーマ直径 8.3mm以上
今後の展開
山中教授の研究グループは、以前、iPS細胞由来のキメラマウスで確認された腫瘍は、外来から導入したc-Myc遺伝子の活性化によるものであることを見いだしています。しかし、本研究における奇形腫の発生にはc-Mycは関与していません。iPS細胞に関連する腫瘍は、種類によって形成のメカニズムの異なることが明らかとなりました。
本研究成果は、SNSの腫瘍形成には、iPS細胞の樹立に用いる体細胞の種類によって大きく変化することを示しています。TTF-iPS細胞由来のSNSは、高い腫瘍形成傾向を示し、MEF-iPS細胞、Stm-iPS細胞由来のSNSでは、ES細胞に匹敵するほど低率でした。Hep-iPS細胞由来のSNSでは中程度でした。
これらの結果を踏まえると、in vitroでのSNSへの分化誘導に基づくiPS細胞の移植安全性評価法は、精度が高い方法の一つと考えられます。
これまで、ヒトiPS細胞の樹立には、皮膚由来の線維芽細胞や、毛胞の角化細胞や、末梢血の有核細胞が用いられています。今回の研究成果は、今後の再生医療への応用へ向けた、ヒトiPS細胞の安全性の確保に関して、由来が異なるiPS細胞の特性を吟味することの重要性を示すとともに、数多くのiPS細胞株の中から移植安全性に優れた株を評価、選抜する方法の重要性と方向性を明示するものと期待されます。
本研究への支援
本共同研究は、下記機関より資金的支援を受け実施されました。
- 文部科学省「再生医療の実現化プロジェクト」
- 独立行政法人医薬基盤研究所(NIBIO)「保健医療分野における基礎研究推進事業」
- 独立行政法人科学技術振興機構(JST) 「戦略的創造研究推進事業」
- 独立行政法人日本学術振興会(JSPS)
- 厚生労働省
- 社団法人日本損害保険協会
- 慶應義塾学事振興資金
- 朝日新聞(7月10日 33面)、京都新聞(7月10日 27面)、産経新聞(7月10日 2面)、日刊工業新聞(7月10日 1面)、日本経済新聞(7月10日 34面)、毎日新聞(7月10日 2面)および読売新聞(7月10日 2面)に掲載されました。

