2008年7月25日
 永田和宏 再生医科学研究所教授らの研究グループの研究成果が、米国科学誌「サイエンス」誌に掲載されることになりました。
永田和宏 再生医科学研究所教授らの研究グループの研究成果が、米国科学誌「サイエンス」誌に掲載されることになりました。
タンパク質の細胞内品質管理を担う新規還元酵素を発見
“ERdj5 is required as a disulfide reductase for degradation of misfolded proteins in the ER.”
Ryo Ushioda, Jun Hoseki, Kazutaka Araki, Gregor Jansen, David Y. Thomas & Kazuhiro Nagata,
研究成果の概要
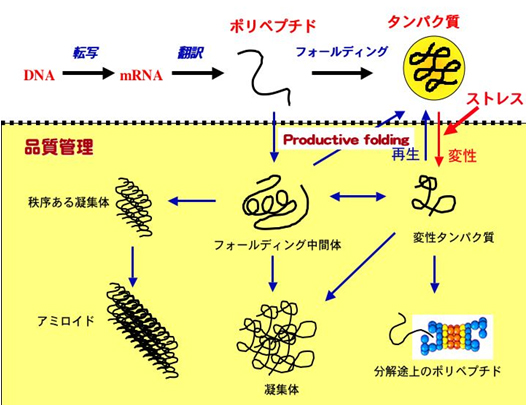 細胞内のタンパク質は、合成されるだけでは機能を持たず、正しく折り畳まれて(フォールディングされて)構造を獲得し、そこで初めて機能を獲得する。遺伝的変異や細胞にかかる種々のストレスによって、タンパク質が正しい構造を獲得できないとき、それらはきわめて不安定で、凝集体やアミロイド線維を作りやすい。従来の分子生物学や生化学では、正しくフォールディングしたタンパク質にしか注意が向けられていなかったが、細胞内には合成直後のポリペプチドから分解されようとしているものまで、さまざまな状態のタンパク質がひしめいていることが明らかになってきた。
細胞内のタンパク質は、合成されるだけでは機能を持たず、正しく折り畳まれて(フォールディングされて)構造を獲得し、そこで初めて機能を獲得する。遺伝的変異や細胞にかかる種々のストレスによって、タンパク質が正しい構造を獲得できないとき、それらはきわめて不安定で、凝集体やアミロイド線維を作りやすい。従来の分子生物学や生化学では、正しくフォールディングしたタンパク質にしか注意が向けられていなかったが、細胞内には合成直後のポリペプチドから分解されようとしているものまで、さまざまな状態のタンパク質がひしめいていることが明らかになってきた。
細胞内にタンパク質の凝集ができると、細胞の生存は危機に瀕することになり、これらがアルツハイマー病やハンチントン病、パーキンソン病やBSE(プリオン病)など、さまざまのフォールディング異常病の原因となる。
このような事態を回避するため、それぞれの細胞は品質管理機構を備えている。品質管理機構は小胞体におけるものがもっともよく調べられているが、そこではミスフォールドしたタンパク質が生じた場合、主として4つの品質管理機構が作動する。第一の手段は生産ラインの一時停止(翻訳ストップ)、第二は不良品の修理のためのタンパク質(分子シャペロン)の誘導、第三は修理できない不良品の廃棄処分(小胞体関連分解)、そして最後の手段として工場閉鎖(アポトーシスによる細胞死)がある(詳しくは、今月出版された「タンパク質の一生」永田和宏著、岩波新書参照)。
私たちは以前にミスフォールドしたタンパク質の分解処理に関わる新規タンパク質EDEMを発見、報告してきた(EMBO Report, 2001, Science 2003など)。EDEMは分解すべきタンパク質を認識して分解を促進するタンパク質であるが、今回EDEMに会合して、小胞体関連分解に関与する新しいタンパク質ERdj5を発見した。ERdj5はミスフォールドしたタンパク質のジスルフィド結合(S-S結合)を還元(開裂)することができる、小胞体内の初めての還元酵素である。さらにERdj5は小胞体の代表的な分子シャペロンBiPとも結合することを明らかにし、小胞体関連分解にはEDEM/ERdj5/BiPというきわめて重要なタンパク質が複合体を作りながら役割分担をしていることを明らかにし、小胞体におけるタンパク質品質管理のもっとも重要な分解の機構の統合的なスキームを描くことに成功した。
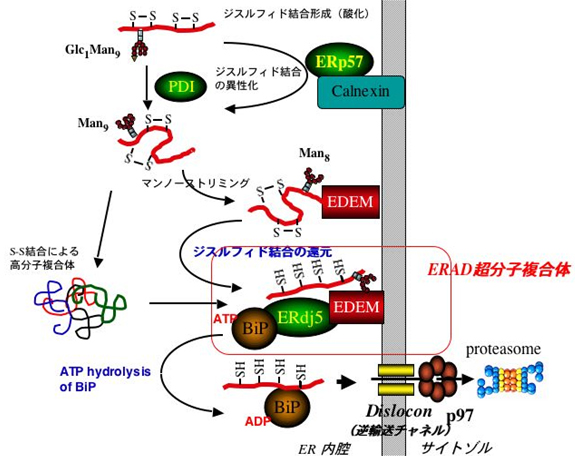 すなわち、ミスフォールドしたタンパク質はEDEMによってまず認識される。ミスフォールドしたタンパク質はジスルフィド結合によって高分子複合体を作ってしまうが、これは小胞体からサイトゾルへの逆輸送に使われるチャネルを通過できない。EDEMに結合したERdj5はこのジスルフィド結合を開裂し、高分子複合体の構造を解くことによって、一本のポリペプチドの状態にunfoldする。一方、ERdj5に結合したBiPはミスフォールドタンパク質をunfoldしたポリペプチド状態に保ったまま逆輸送チャネルにまで運ぶと考えられる。BiPのERdj5への結合はATPの有無によって制御されており、ATPがADPに加水分解されるとERdj5から解離して基質(ミスフォールドタンパク質)をEDEMなどから引き抜いてチャネルへ運ぶ。
すなわち、ミスフォールドしたタンパク質はEDEMによってまず認識される。ミスフォールドしたタンパク質はジスルフィド結合によって高分子複合体を作ってしまうが、これは小胞体からサイトゾルへの逆輸送に使われるチャネルを通過できない。EDEMに結合したERdj5はこのジスルフィド結合を開裂し、高分子複合体の構造を解くことによって、一本のポリペプチドの状態にunfoldする。一方、ERdj5に結合したBiPはミスフォールドタンパク質をunfoldしたポリペプチド状態に保ったまま逆輸送チャネルにまで運ぶと考えられる。BiPのERdj5への結合はATPの有無によって制御されており、ATPがADPに加水分解されるとERdj5から解離して基質(ミスフォールドタンパク質)をEDEMなどから引き抜いてチャネルへ運ぶ。
EDEM/ERdj5/BiPの3者複合体が小胞体関連分解に関与しているという概念自体がまったく新しく、更に世界的にも発見が待たれていた小胞体内のジスルフィド還元酵素が分解に重要であることを発見したことも大きい。前述のように、タンパク質品質管理機構が破綻することによって多くの神経変性疾患が惹起されるが、本研究はそのような神経変性を初めとするフォールディング異常病の治療戦略にとっても大切な知見を提供すると考えられる。
- 朝日新聞(7月25日 29面)、京都新聞(7月25日 27面)および読売新聞(7月25日 2面)に掲載されました。

