2012年10月5日

篠原助教
精子幹細胞移植法では、精細管内腔に注入された幹細胞が、精細管の基底幕側にある幹細胞ニッシェ(幹細胞の生息する微小環境)にたどり着きます(この現象をホーミングといいます)。篠原美都 医学研究科助教、篠原隆司 同教授、小倉淳郎 理化学研究所遺伝子工学基盤技術室長らの研究グループはこれまでにホーミングに関わる分子機構を解明してきましたが、今回新たにGDNFとCXCL12というケモカイン(走化性因子:細胞の遊走を促す物質)の関与を明らかにしました。この発見を可能にしたのは、精子幹細胞のニッシェを試験管内で再構成した培養系の確立です。この培養系では精子幹細胞がニッシェへとホーミングし、コロニーを形成する動態が再現され、それに基づいて、幹細胞のホーミング活性に影響を及ぼす分子のスクリーニングを行った結果、GDNFとCXCL12を見いだし、さらにこれらの物質が実際に精巣内でもホーミングに使われていることを明らかにしました。
本研究成果は米国科学誌「Cell Stem Cell」誌(2012年10月5日号)に掲載されました。
研究の内容
試験管内での幹細胞ニッシェの再構成とそれを用いたホーミングアッセイ系の開発
幹細胞は、ニッシェと呼ばれる特殊な微小環境において生息しています。ニッシェは、幹細胞の増殖や分化に必要な栄養素やシグナルを提供する、重要な働きをしています。骨髄移植では血液幹細胞がレシピエントの体内で造血を起こすには、ホーミングと呼ばれる現象によりニッシェに到達して増殖することが必要であり、ケモカイン(走化性因子)と呼ばれるタンパク質がニッシェで発現され、幹細胞を引き寄せる働きをしていると考えられています。
精子形成の源である幹細胞(精子幹細胞)は骨髄移植と同様に、精巣内に移植するとニッシェに到達して生着し、ドナー細胞由来の精子形成をすることができます。研究グループは、そのプロセスに血液幹細胞のホーミング現象と類似したケモカインの関与があるのではないかと考えました。候補と考えられる物質の効果を調べるため、試験管内でホーミング現象を模倣した培養系を開発しました。
研究グループは、2003年に精子幹細胞の長期培養系を報告しました。この培養系(Germline Stem: GS細胞)では、Glial cell-line derived neurotrophic factor(GDNF; 精子幹細胞の自己複製因子)の存在化で精巣細胞を胎児由来の線維芽細胞(mouse embryonic fibroblast: MEF)の上で培養するとフィーダー細胞の上で盛り上がった形のコロニーを形成して2年以上増殖し、精巣内に移植すると精子を形成することができます。
本研究ではMEFではなく、精巣の体細胞をフィーダーに用いました。精子形成のない不妊マウスの精巣細胞を培養し、精巣の主要な支持細胞であるセルトリ細胞が広がった状態をまず作出し(これを精巣フィーダー細胞といいます)、その上にGS細胞を播種すると、セルトリ細胞の上だけでなく下にも潜り込み「敷石状コロニー」(cobblestone colony)を作りました。骨髄細胞の培養では骨髄の支持細胞が広がった層の下に、血液幹細胞や前駆細胞が敷石状コロニーを形成することが知られており、試験管内で骨髄細胞によって再構成された幹細胞ニッシェに幹細胞がホーミングしたものと考えられています。幹細胞活性の試験管内判定の手段としても使われ、特に移植アッセイの行えないヒトの造血活性の測定に極めて有用とされてきました。今回研究グループが観察した敷石状コロニーは、造血系で見られるものと形がとても似ており、造血系と同様に精子幹細胞のニッシェの再構成とホーミングが起きた結果と考えられました。
以下に挙げる実験結果がその考えを支持していました。
- これまでの研究で、精子幹細胞のホーミングには接着分子のIntegrin(インテグリン)が必要であることが分かっていますが、IntegrinB1の欠損したGS細胞では敷石状コロニーの形成率が低下していました。
- GS細胞だけでなく精巣の精子幹細胞も敷石状コロニーを形成しました。
- 精巣の細胞から抗IntegrinA6抗体を使って幹細胞を濃縮したところ、精巣内移植によるコロニー形成率と試験管内での敷石状コロニー形成率の両方が上昇していました。
この培養系で用いた精巣フィーダー細胞は、不妊マウスの精巣を無血清培地で培養したのち、細胞の増殖能を抑えるためMytomycinCで処理し、細胞外基質ラミニンでコートされた培養皿の上に播種したものです。免疫染色でどのような細胞からフィーダーが構成されているか調べてみると、大部分にセルトリ細胞が広がっており、一部にLeydig(ライディッヒ)細胞やMyoid(筋様)細胞も認められました。しかし、敷石状コロニーが形成される部位とこれらの細胞の分布に相関があるかは分かっていません。
GDNFおよびCXCL12が精子幹細胞のホーミング制御に関わることの発見
研究グループは精巣フィーダー細胞を用いて、精子幹細胞のホーミング活性に影響する因子をスクリーニングしました。EGFPを発現するGS細胞を様々な培養条件下で精巣フィーダー細胞に播種し、形成される敷石状コロニーの数を測定しました。その結果、以下の結果から精子幹細胞の自己複製因子として知られてきたGDNF(glial cell-line derived neurotrophic factor)がホーミングを促進することが分かりました。
- GDNFの培養中への添加により敷石状コロニー形成が亢進し、逆にGDNFへの中和抗体により低下しました。
- GDNFの受容体Retのdominant negative体にてGDNFシグナルを阻害すると、敷石状コロニーおよび移植精巣でのコロニーの形成が低下しました。
GDNFは精子幹細胞の自己複製増殖を促進するサイトカインとして知られてきましたが、神経細胞などでは増殖の促進以外に、細胞の遊走を促すケモカインとしての働きもあることが知られています。本研究の結果は、精子幹細胞でもGDNFが両方の作用を持つことを明らかにしました。
また、血液幹細胞や始原生殖細胞のホーミングに関与すると報告されているCXCL12が、精子幹細胞のホーミングも促進することが以下の結果から分かりました。
- CXCL12の培養中への添加により敷石状コロニー形成が亢進し、逆にCXCL12への中和抗体により低下しました。
- CXCL12の受容体CXCR4のノックアウトマウスから、CXCR4欠損した精子幹細胞を採取し、ホーミング活性を調べたところ、敷石状コロニーおよび移植によるコロニー形成が低下しました。
- CXCL12を精巣の支持細胞(セルトリ細胞)に高発現させ、その精巣をホストとして精子幹細胞を移植すると、コロニー形成が亢進しました。
CXCL12は別名SDF-1とも呼ばれ、1994年に研究グループの一人である長澤丘司らが発見しました。CXCL12は造血系の細胞を骨髄ニッシェへ誘導するケモカインであることが分かり、その阻害剤AMD3100も含め、臨床で広く用いられています。さらに長澤らはCXCL12が胎生期の生殖細胞を生殖腺へと誘導する働きもしていることを2003年に報告していますが、生後の生殖細胞での関与は分かっていませんでした。今回初めてCXCL12の作用が成人の精巣でもニッシェへのホーミングという形で続いていることが証明されました。
さらに研究グループは、GS細胞におけるCXCR4の発現量がGDNFによって亢進することが発見しました。これらのことからGDNFやCXCL12がニッシェにおいて発現し、両方のシグナルが協調して精子幹細胞のホーミング活性を高めることが明らかになりました。
研究成果の実用的な意義
- ホーミングシグナルの解明の意義
精子幹細胞の移植による生着率はマウスでも5~10%と低く、さらに他の動物種では著しく低いため、実用化を阻んでいます。男性不妊症の治療や、家畜や遺伝子改変動物作成のためにこの移植法を実用化するためには移植効率の改善が必須です。特に小児の癌治療の副作用である男性不妊症に対しては、精子の保存ができないため、精子幹細胞の保存と癌治療後の自家移植が有効な手段として期待され、ホーミングの分子機構の解明は移植効率の改善に役立つと期待されています。 - ニッシェの再構成系の確立の意義
これまで移植だけが精子幹細胞活性を機能的にアッセイする手段でしたが、この培養系の確立により、試験管内でのアッセイが可能となりました。移植によるアッセイが幹細胞活性のスタンダードの基準であることに変わりありませんが、移植より迅速(2ヶ月vs1~2週間)、かつ安価で容易に行えること、またヒトなど移植法の確立していない動物種で幹細胞活性を判定するのに有効であるなどの利点があります。
また、精巣内のニッシェは遺伝子操作や観察が困難ですが、試験管内でニッシェを再構成できたことで、ニッシェの作用や幹細胞の動態に及ぼす影響を試験管内の実験で解析できるようになりました。
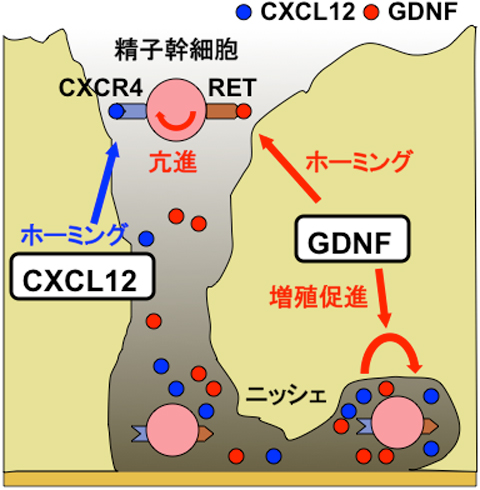
精子幹細胞のホーミングのメカニズム
ニッシェにて発現されるGDNFは精子幹細胞に発現する受容体Retに結合し、その自己複製増殖を促すと同時に、ニッシェへのホーミング活性を促進する。またニッシェに発現するもう一つの分子CXCL12は精子幹細胞に発現する受容体CXCR4に結合し、ホーミング活性を促進するが、増殖には影響を与えない。GDNFはさらに精子幹細胞におけるCXCR4の発現を促進することで、CXCL12の刺激を受けやすい状態にし、両者は協調して精子幹細胞のホーミングを活性化する。
本研究は内閣府の管轄する最先端・次世代研究開発支援プログラム、CREST、文部科学省・科学研究費補助金による研究費により行われました。
書誌情報
[DOI] http://dx.doi.org/10.1016/j.stem.2012.06.011
タイトル
Reconstitution of mouse spermatogonial stem cell niche in culture
マウス精子幹細胞の支持環境の試験管内での再構成
掲載誌
Cell stem cell 11(4), 5 October 2012, p.567-578
著者
篠原美都:京都大学大学院医学研究科・遺伝医学講座・分子遺伝学教室
井上貴美子:理化学研究所・筑波
高島誠司:京都大学大学院医学研究科・遺伝医学講座・分子遺伝学教室
竹橋正則:京都大学大学院医学研究科・遺伝医学講座・分子遺伝学教室(現大阪大谷大学)
越後貫成美:理化学研究所・筑波
森本裕子:京都大学大学院医学研究科・遺伝医学講座・分子遺伝学教室
長澤丘司:京都大学大学院医学研究科・再生医科学研究所・生体システム制御学分野
小倉淳郎:理化学研究所・筑波
篠原隆司:京都大学大学院医学研究科・遺伝医学講座・分子遺伝学教室
- 京都新聞(10月5日 24面)および産経新聞(10月5日 23面)に掲載されました。

