2012年8月24日


左から佐藤准教授、今井研究員
このたび、佐藤ゆたか 理学研究科准教授、今井 薫 同研究科 元特任助教・現日本学術振興会特別研究員(RPD)らの研究グループの研究成果が、2012年8月24日発行の米国科学雑誌「Science」にて公表されました。
要点
- 動物胚の背腹軸(背側と腹側)を作るために重要となるBMPとよばれる細胞外分泌性のタンパク質を介する分子機構について、BMP様タンパク質Admpの作用機序を明らかにしました。
Admpは腹側をつくるために働きますが、同時にPinheadと呼ばれるタンパク質の発現を誘導し、その誘導されたPinheadタンパク質によってその機能を抑制されます。そのようにして、いわばアクセルとブレーキを両方同時に巧みに操作することで、腹側の領域の大きさが正確に決められます。 - AdmpとPinhead遺伝子はゲノム上で隣接して存在しますが、その両者の間に両方の遺伝子発現に必要な共通のDNA配列(エンハンサー配列)を持っており、それがスイッチのように働くことで、1つの細胞ではどちらか片方の遺伝子だけが発現するようになっています。
本研究は、ゲノムの構造変化によって遺伝子の発現調節が直接おこなわれていることをしめした世界初の成果です。 - 今回明らかにした機構は、このスイッチング機構を含めて、広く動物界で使われている機構だと考えられます。
背景
すべての動物の発生は受精卵に始まり、細胞分裂を経て、体づくりを行なっていきます。ほとんどの動物の胚(発生中の個体)ではごく初期に背側と腹側(背腹軸)が決められます。その機構はSpemannとMangoldによる形成体の発見(1924)以降、多くの研究者が研究をおこなってきました。その結果、この背腹軸決定にはBMPと呼ばれる細胞外に分泌されるタンパク質が重要な役割を果たしていることがわかってきました。たとえば、カエルではBMPタンパク質は腹側の細胞で発現して、腹側の発生プログラムを始動させます。背側ではBMPタンパク質の働きを阻害する分子が発現して、腹側の発生プログラムを始動させないようにしています(図1)。
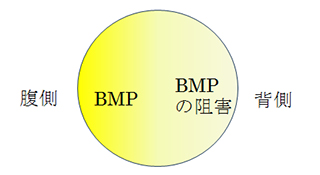
図1:脊索動物の初期胚の模式図
脊索動物胚ではBMPが腹側の発生プログラムを始動する
不思議なことに、背側ではAdmpと呼ばれるBMPタンパク質に類似のタンパク質が発現しています。このタンパク質は細胞外に分泌されたあと、腹側に輸送され、そこでBMPタンパク質と同様に腹側の発生プログラムを始動させるとされていますが、未解明の部分も多く残されています。
今回の成果
多くの動物が共通に持つこの背腹軸決定の機構について、ホヤを用いて研究を行いました。ホヤは脊椎動物にもっとも近縁な動物群である尾索類に属する動物です。ホヤの体づくりのメカニズムの概要は2006年に本研究グループが明らかにしましたが(今井ら、Science, 2006)、背腹軸決定のメカニズムの詳細は必ずしも明らかではありませんでした。本研究グループは自身が10年前に決定したホヤゲノム配列に基いた(Dehal&佐藤ら、Science, 2002)バイオインフォマティクス解析に、実験的解析を組み合わせて、Admpを阻害するタンパク質Pinhead(ピンヘッド)を同定しました。背側から輸送されてくるAdmpは、腹側でBMP遺伝子とPinhead遺伝子を発現させます。BMPは腹側の発生プログラムを始動しますが、PinheadはAdmpの働きを抑制します。それによって、Admpの作用できる領域が腹側の領域だけに限定されるという機構を明らかにしました(図2)。Pinheadが機能しないと、Admpが働きすぎて、腹側の領域が大きくなってしまいます。
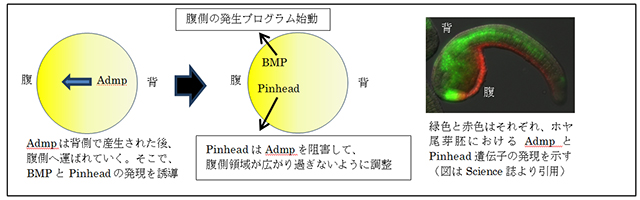
図2:AdmpとPinheadの機能
この機構が有効に働くためには、Admp遺伝子はPinhead遺伝子が発現している場所では発現しないことを保証する必要があります。その機構はどのようになっているのでしょうか。興味深いことにPinhead遺伝子は、昆虫から魚類・両生類といった脊椎動物までのゲノムDNAの中で、Admp遺伝子の隣に存在しています(鳥類とほ乳類ではAdmpおよびPinhead遺伝子の両方または一方がありません)。遺伝子の並びがこのように高度に保存されている例は稀で、理由があって進化的に保存されてきたと考えることが妥当です。図3に示すように遺伝子の発現には通常、一つのプロモーターと一つ以上のエンハンサーと呼ばれるDNAの領域が必要となります。プロモーターにはRNA polymerase IIと呼ばれるタンパク質が結合し、遺伝子が発現しますが、その結合には通常、少し離れた位置にあるエンハンサーにある種のタンパク質(転写調節タンパク質)が結合し、RNA polymerase IIのプロモーターへの結合を補助します。今回、本研究グループはPinhead遺伝子とAdmp遺伝子の間に両者で共通に使われるエンハンサー領域が存在していることを見つけました(図4)。
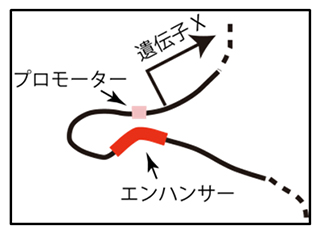
図3:遺伝子が発現するときの一般的な様子
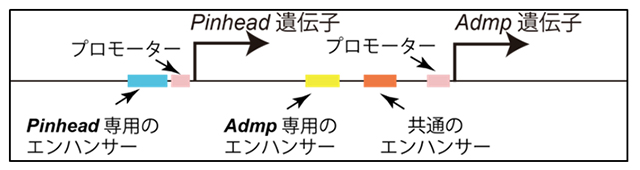
図4:AdmpとPinheadをコードするゲノム領域の構造
Pinhead遺伝子がこのエンハンサーの助けを得て発現しているときは、このエンハンサーとPinhead遺伝子の間に存在するAdmpエンハンサーは物理的に隔離されて、Admpプロモーターへの関与ができません。この共通エンハンサーがいわばスイッチとして働くことによって、Pinhead遺伝子が発現している細胞では必ずAdmp遺伝子の発現が「オフ」になります(図5)。このスイッチ機構はPinheadとAdmpのもつ相反する機能を実現するためには必要不可欠であり、それこそが、長い間、進化の過程で、変化せずに保たれてきた理由であると考えられます。また、同様の機構がメダカ胚でも働いていることを日下部岳広 甲南大学教授の研究室の協力を得て、確認しました。
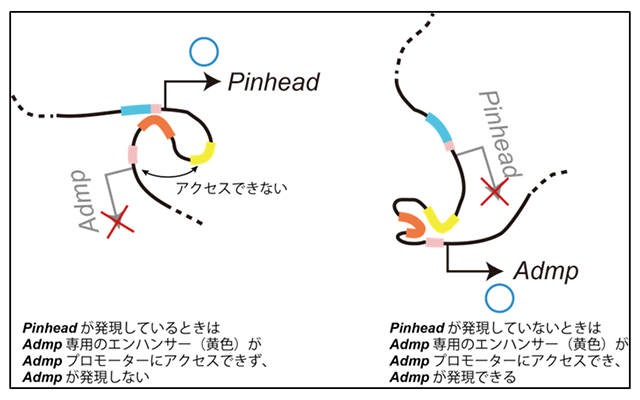
図5:Pinhead遺伝子の発現によるAdmp遺伝子発現の抑制の様子
書誌情報
[DOI] http://dx.doi.org/10.1126/science.1222488
Imai Kaoru S., Daido Yutaka, Kusakabe Takehiro G., Satou Yutaka
Cis-Acting Transcriptional Repression Establishes a Sharp Boundary in
Chordate Embryos. Science, 337(6097), p.964-967, August 24, 2012
doi: 10.1126/science.1222488
- 本研究は、本学大学院理学研究科生物科学専攻 発生ゲノム科学研究室にて行われました。
本研究成果は、主に、以下の日本学術振興会・文部科学省 科学研究費補助金によって行われました。
- 若手研究(S) 21671004 (佐藤ゆたか)
- 研究活動スタート支援 22870018 (今井薫)
また、部分的に以下の支援を受けました。
- 京都大学女性研究者支援センター 研究・実験補助者雇用制度 (今井薫)
- GCOEプロジェクト(A06) (今井薫)
- 日本学術振興会特別研究員(RPD)制度 (今井薫)
- 日本学術振興会・文部科学省 科学研究費補助金 (基盤研究(B) 22310120 (日下部岳広))
実験材料は、ナショナルバイオリソースプロジェクト(カタユウレイボヤ)を通じて入手しました。
- 京都新聞(8月24日 27面)、日刊工業新聞(8月24日 18面)および日本経済新聞(8月24日夕刊 18面)に掲載されました。

