2011年8月2日

左から竹島教授、山崎特定講師
竹島浩 薬学研究科教授、山崎大樹 特定講師らの研究グループは、小胞体カウンターイオンチャネルであるTRICチャネルが血管平滑筋において興奮性調節のシグナル伝達に参画することにより、血圧調節に寄与する機構を詳細に解明しました。さらに、ヒトTRICチャネル遺伝子の一塩基多型が本態性高血圧の発症に密接に関与すること、さらには、高血圧リスク一塩基多型を有する高血圧患者は汎用される降圧薬に対して抵抗性を示すことも明らかにしました。この研究成果が、「Cell Metabolism誌(8月3日号)」に掲載されることになりました。
【論文情報】
TRIC-A Channels in vascular Smooth Muscle Contribute to Blood Pressure Maintenance
Daiju Yamazaki, Yasuharu Tabara, Satomi Kita, Hironori Hanada, Shinji Komazaki, Daisuke Naitou, Aya Mishima, Miyuki Nishi, Hisao Yamamura, Shinichiro Yamamoto, Sho Kakizawa, Hitoshi Miyachi, Shintaro Yamamoto, Toshiyuki Miyata, Yuhei Kawano, Kei Kamide, Toshio Ogihara, Akira Hata, Satoshi Umemura, Masayoshi Soma, Norio Takahashi, Yuji Imaizumi, Tetsuro Miki, Takahiro Iwamoto and Hiroshi Takeshima
研究の概要
細胞内小器官である小胞体はCa2+を貯蔵し、各種の刺激に応答してCa2+を細胞質へ放出する機能を備えています。小胞体Ca2+放出による細胞質のCa2+濃度上昇は恒常性や機能維持に重要であり、筋細胞の収縮、伝達物質の放出、遺伝子の発現、細胞死や細胞増殖など様々な生理反応を制御しています。小胞体Ca2+放出を担当するイオンチャネルとしてリアノジン受容体とイノシトール三リン酸受容体が知られており、それぞれ独自の機構によりCa2+を放出します。両チャネルの開口に伴い陽イオンであるCa2+が放出されると、小胞体内腔に負の電荷が発生することになり、以降のCa2+放出が抑制されることが推定されます。生理的条件下で観察される数十ミリ秒に及ぶ小胞体Ca2+放出が持続するためには、この負電荷を中和する機構が必要であると想定されます。この機構を担う分子であるカウンターイオンチャネルとして、一価陽イオン特異的なTRICチャネルが数年前に京都大学大学院薬学研究科にて同定されました。動物においては、TRIC-AとTRIC-Bの2種類のTRICチャネルサブタイプが独自の組織特異的パターンにより分布しています。両サブタイプは3本の膜貫通セグメントを有して、核膜や小胞体膜内でホモ3量体を形成し、細胞内環境下では主にK+透過性チャネルとして機能しています。TRIC-Aチャネルは筋組織や脳などの興奮性細胞群に高発現することが確認されていましたが、その生理的意義については不明でした。
本研究は、TRIC-A遺伝子欠損マウスにおいて観察された高血圧に注目しました。この変異マウスの血管平滑筋細胞では、小胞体膜上のリアノジン受容体と細胞膜上の大コンダクタンスCa2+依存性K+チャネルによる過分極シグナルが障害されており、興奮性の亢進による電位依存性Ca2+チャネルの異常活性化も確認されました。従って、血管平滑筋の過分極シグナルはTRIC-Aチャネル、リアノジン受容体とCa2+依存性K+チャネルの機能共役により成立していることが判明しました。一方、正常血圧群と高血圧患者群におけるヒトTRIC-A遺伝子内の一塩基多型(SNPs, single nucleotide polymorphisms)を検討した結果、日本人の約7%で観察されるSNP型で本態性高血圧の発症が18%上昇することが明らかになりました。さらに、この高血圧リスクSNPsを有する高血圧患者においては、一般に処方される降圧薬3種に対して抵抗性を示すことも明らかとなりました。TRIC-Aチャネルが血圧調節に関与しているという新たな発見は本態性高血圧の病態解明へ貢献するものであり、高血圧の予防、降圧薬選択や投薬量決定などの個別化医療への展開が期待されます。
研究の成果
TRIC-A欠損マウスにおける高血圧
マウスは夜行性であり、交感神経系が優位な夜間に血圧が上昇します。そこでまず、慨日リズムによる血圧変動を計測するため、テレメトリーを用いて24時間連続の血圧計測を行いました。その結果、TRIC-A欠損マウスは昼間の時間帯のみ高血圧を示し、夜間は正常マウスと同程度の血圧でした(図1A)。従って、TRIC-A欠損マウスは、脳梗塞や心筋梗塞の発生リスクが特に高いとされる夜間高血圧症の有用な動物モデルであることが判明しました。次に、テールカフ法により各種の降圧薬(ほぼ最大効果の投薬量)に対する効果を正常マウスとTRIC-A欠損マウスで比較しました(図1B)。収縮期血圧の降圧値で両群を比較すると、多くの薬物で同程度の効果が観察されたものの、電位依存性Ca2+チャネル阻害薬でのみ顕著な降圧効果がTRIC-A欠損マウスにて観察されました。これらの結果から、Ca2+チャネル阻害薬の標的となる血管での非交感神経性の収縮亢進が、TRIC-A欠損マウスの高血圧において推定されます。
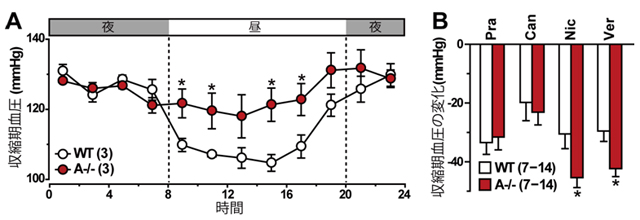
- 図1 TRIC-A欠損マウスにおける高血圧
(A)血圧テレメトリー計測によるTRIC-A欠損マウスにおける慨日血圧変動。(B)昼期のテールカフ計測による過剰降圧薬による血圧降下作用。Pra:アドレナリンα1受容体阻害薬プラゾシン、Can:アンジオテンシンII受容体阻害薬カンデサルタン、Nic:電位依存性Ca2+チャネル阻害薬ニカルジピン、Ver:電位依存性Ca2+チャネル阻害薬ベラパミル。
TRIC-A欠損抵抗血管の筋原性収縮異常とTRIC-A欠損血管平滑筋細胞におけるCa2+動態異常
血圧動態は抵抗血管と呼ばれる末梢動脈の収縮調節により主に支配されており、単離抵抗血管の収縮性は血管径を直接観察することにより得られる筋原性収縮により評価されます。そこで代表的な抵抗血管である腸間膜動脈を調製し、血管径を測定しました。血管の最大弛緩を示すCa2+除去溶液中では、TRIC-A欠損マウスの血管径に異常は観察されませんでした。一方で、通常の灌流溶液中(2mM CaCl2を含む)においては、TRIC-A欠損マウスの血管が正常マウスの血管に比べて顕著に細いことが分かりました(図2A)。従って、TRIC-A欠損による血管平滑筋の収縮亢進が高血圧の主原因であることが示されました。
血管平滑筋の収縮と弛緩は、基本的には細胞内Ca2+濃度変化によって規定されています。内皮細胞を除去した腸間膜動脈平滑筋細胞内Ca2+濃度を蛍光色素法により測定したところ、TRIC-A欠損マウス血管平滑筋細胞にて定常状態の細胞内Ca2+濃度が顕著に上昇していることが明らかとなりました。細胞外液のCa2+除去や電位依存性Ca2+チャネル阻害薬ベラパミルによって正常マウス血管平滑筋細胞のCa2+濃度と同程度まで低下しました。従って、TRIC-A欠損細胞における細胞質Ca2+濃度の上昇は、細胞外からのCa2+流入の亢進が原因であり、電位依存性Ca2+チャネルの活性化を介していることが示唆されました(図2B)。さらに、TRIC-A欠損血管平滑筋細胞では、小胞体Ca2+貯蔵量の増大やα1アゴニスト刺激の際のIP3Rを介したCa2+放出の増大といった異常が観察されましたが、これらは直接的に高血圧を誘導するものとは考えられませんでした。
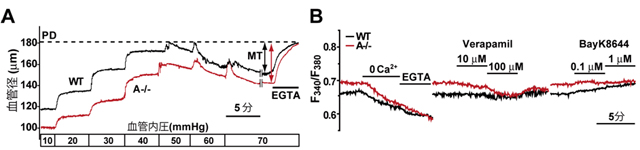
- 図2 TRIC-A欠損腸間膜動脈の筋原性収縮異常とTRIC-A欠損血管平滑筋細胞におけるCa2+ハンドリング異常
(A)腸間膜動脈の血管径モニタリング。血管内圧を変化させた際の血管径の経時変化。(B)腸間膜動脈より内皮細胞を剥離した試料を用いて、Fura-PE3を負荷した抵抗血管平滑筋の細胞内Ca2+動態を蛍光可視化イメージング解析した。細胞外溶液からのCa2+除去、Ca2+チャネル阻害薬ベラパミルまたは活性化薬BayK8644の定常状態の細胞内Ca2+濃度に対する効果を検討した。
TRIC-A欠損血管平滑筋細胞における過分極シグナル障害
血管平滑筋におけるリアノジン受容体からの自発的なCa2+放出(Ca2+スパーク)は細胞膜直下で局所的に発生し、細胞膜上のCa2+依存性K+チャネルを活性化して、細胞膜を過分極させることにより、電位依存性Ca2+チャネルを不活性化させCa2+流入を抑制する結果、血管を弛緩させます(血圧低下)。上述したように血管平滑筋の収縮亢進は、電位依存性Ca2+チャネルを介したCa2+流入に起因しますので、過分極シグナルが障害されていることが予想されます。そこで、過分極シグナルが障害されているかを調べるため、単離血管平滑筋細胞を用いてCa2+スパークを測定しました。その結果、Ca2+スパークの振幅の大きさや発生数は正常であるのに対して、頻度が顕著に減少していました(図3A)。次にCa2+スパークによって活性化するBKチャネル電流を自発的一過性外向き電流(STOCs, spontaneous transient outward currents)によって検討しました。STOCsにおいても発生頻度が減少していたことからCa2+スパーク頻度の減少と矛盾のない結果が得られました(図3B)。続いて、STOCs頻度の減少は膜を脱分極することが知られていますので、膜電位感受性色素を用いた膜電位測定を行いました。その結果、TRIC-A欠損血管平滑筋細胞での膜電位は正常マウス血管平滑筋細胞に比べて有意に脱分極しており、また脱分極からの回復(再分極)時間が有意に延長することが明らかとなりました。以上の結果を総合的に考察すると、TRIC-A欠損平滑筋ではリアノジン受容体の開口が阻害され、STOCが低下して、静止膜電位の上昇を含む興奮性が亢進するものと考えられます。
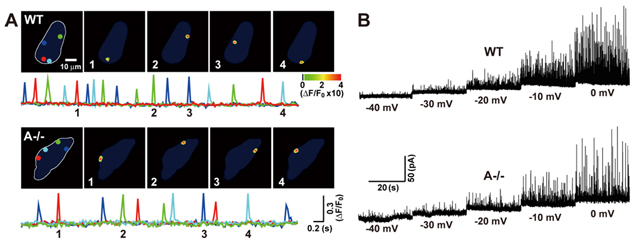
- 図3 TRIC-A欠損血管平滑筋細胞における過分極シグナル異常
(A)Ca2+スパークを全反射顕微鏡にて測定した。Ca2+スパークの代表的データ。(B) パッチクランプ法によるSTOC測定実験。STOC測定の代表的なデータ。
従って、TRIC-A欠損マウス血管平滑筋細胞では、Ca2+スパーク頻度が減少したことに伴い、STOCs頻度が減少した結果、膜が脱分極し電位依存性Ca2+チャネルからのCa2+流入が増加することで、定常状態での細胞内Ca2+濃度上昇が起こり、平滑筋収縮亢進によって高血圧に至ったことが明らかとなりました(図4)。
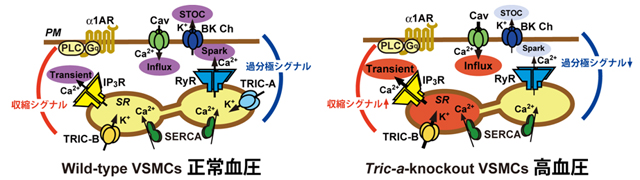
- 図4 血管平滑筋細胞における細胞内Ca2+シグナルとTRIC-A欠損による変化
ヒトTRIC-A遺伝子 SNPsと高血圧
現在、本邦では約4000万人もの高血圧患者がおり、患者数は高齢化に従い増加の一途をたどります。高血圧はサイレントキラーと呼ばれており、放置しておくと様々な臓器障害につながります。例えば、心臓に負担がかかると狭心症や心筋梗塞を引き起こします。また、脳に負担がかかると血管が詰まったり、破れたりすることで脳梗塞や脳卒中など命に関わる病気に至ることが分かっています。多因子疾患である本態性高血圧が遺伝によって発症する割合は30~50%と考えられており、喫煙、運動不足や塩分摂取などの生活習慣とともに高血圧リスク遺伝素因の同定が注目されています。近年では、SNPsに規定される遺伝体質と高血圧の関係が注目されており、SNPsを解析することによって高血圧の発症を予測し、治療薬の選択を行うテーラーメイド医療の確立が期待されています。 上述のように血管平滑筋細胞においてTRIC-Aが血圧調節機構に深く寄与していることが明らかとなったことから、血管平滑筋における遺伝的なTRIC-A遺伝子の発現レベルの増減は個体レベルの血圧値と密接に相関することも予見されます。
愛媛大学医学部グループが構築した日本人集団の高血圧ケース-コントロール試験において(各グループは約1100名)、TRIC-A遺伝子SNPsをPCR法により検討しました。代表的なSNP例としては、TRIC-A遺伝子内領域に存在するrs17796739において、日本人ゲノム集団ではC(シトシン)が74%で、T(チミン)が26%の頻度で存在しています。この部位での低頻度Tのホモ接合体(14人に1人の確率)では、統計上有意(p=0.018)に高血圧を発症するとともに、約18%発症リスクが上昇するものと算出されました。また、rs901792においても低頻度Cのホモ接合体では、統計上有意(p=0.048)に高血圧を発症するとともに、約14%発症リスクが上昇すると算出されました(図5B)。SNP genotypingデータをまとめますと、見出された高血圧リスクSNPsは連鎖不均衡の関係にあることも判明し、TRIC-A遺伝子を中心とする約100 kbに分布していることが示されました(図5A)。従って、TRIC-A遺伝子SNPsは遺伝診断により、高血圧予防などに応用されることが期待されます。
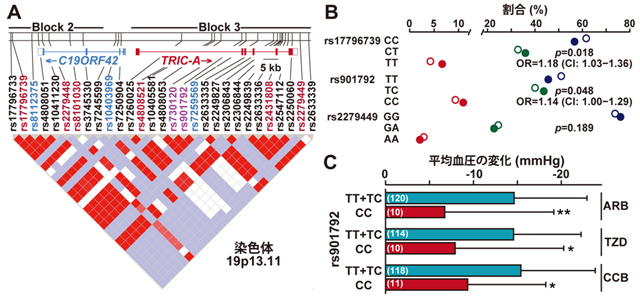
- 図5 TRIC-A遺伝子SNPと高血圧リスク・降圧薬感受性
(A)TRIC-A遺伝子SNPsの高血圧ケース-コントロール試験における解析。TRIC-A遺伝子領域におけるSNPsの連鎖不均衡マップに、高血圧リスクSNPs(p<0.05)を示している。(B)各SNPsでの接合体存在比。rs17796739およびrs901792では低頻度のホモ接合体が統計上有意に高血圧を発症し、発症リスクがそれぞれ約18%、14%上昇する。一方で、rs2279449の低頻度ホモ接合体は高血圧発症リスクが低い。(C)高血圧リスクrs901792Cホモ接合体患者における降圧薬抵抗性。TRIC-A遺伝子中のrs901792において遺伝子型CCの高血圧患者は、他の遺伝子型患者と比較して3剤の降圧効果が顕著に低い。
ヒトTRIC-A遺伝子多型と降圧薬の薬理効果
高血圧治療では作用機序の異なる多彩な降圧薬が現在利用されており、高血圧症の遺伝素因や生活習慣に対応して降圧効果も異なると考えられます。国立循環器病センターが中核となり、汎用される降圧薬であるサイアザイド利尿薬(TZD)、アンジオテンシンII受容体拮抗薬(ARB)とCa2+チャネル阻害薬(CCB)を高血圧患者約130名に処方して、それぞれの降圧効果を検討するとともに、血液試料から遺伝子を抽出する臨床試験(GEANE試験)が既に行われています。そこで我々は、このGEANE試験において上述のTRIC-A遺伝子における高血圧リスクSNPsに注目しました。
TRIC-A遺伝子SNPであるrs901792において、高血圧リスク多型C(シトシン)のホモ接合体において3つの降圧薬に対する抵抗性が示されました(図5C)。降圧効果は薬物治療前の血圧値に依存することから、より正確な薬理効果の検討では前値補正とともに、収縮期、平均および拡張期血圧に分割された評価が求められます。前値補正を含めた検討においても、TRIC-Aリスク多型のホモ接合体では降圧薬抵抗性が確認されました。従って、TRIC-A遺伝子多型は降圧薬の投薬量決定や薬物選択などの個別化治療に貢献することが期待されます。
関連リンク
- 論文は以下に掲載されております。
http://dx.doi.org/10.1016/j.cmet.2011.05.011
http://hdl.handle.net/2433/143634 (京都大学学術情報リポジトリ(KURENAI)) - 以下は論文の書誌情報です。
Yamazaki D, Tabara Y, Kita S, Hanada H, Komazaki S, Naitou D, Mishima A, Nishi M, Yamamura H, Yamamoto S, Kakizawa S, Miyachi H, Yamamoto S, Miyata T, Kawano Y, Kamide K, Ogihara T, Hata A, Umemura S, Soma M, Takahashi N, Imaizumi Y, Miki T, Iwamoto T, Takeshima H. TRIC-A Channels in Vascular Smooth Muscle Contribute to Blood Pressure Maintenance. Cell Metab. 2011 Aug 3;14(2):231-41. PubMed PMID:21803293.
- 京都新聞(8月2日夕刊 8面)、日刊工業新聞(8月3日 19面)、日本経済新聞(8月3日 34面)および読売新聞(8月2日夕刊 10面)に掲載されました。

