2013年4月24日

櫻井講師
櫻井英俊 iPS細胞研究所(CiRA)講師、田中章仁 名古屋大学医学系研究科大学院生(CiRAにて学外研究)らの研究グループは、ヒトiPS細胞から、これまでの手法より短期間で効率よく、さらに再現性高く筋肉細胞を作製することに成功しました。
要旨
これまで、ヒトiPS細胞やES(胚性幹)細胞から筋肉細胞を作製する試みはありましたが、効率が高くない上に再現性が低く、同じ手法を用いても、細胞株が変わると筋肉細胞の出来具合が変わってしまうという問題を抱えていました。
本研究では、細胞の運命を骨格筋細胞へと変えることが知られている転写因子MyoD1を、ヒトiPS細胞に発現させ、約90%近くの効率で骨格筋細胞を作製することに成功しました。また、この手法により1人の三好型筋ジストロフィー患者さんのiPS細胞2株から筋肉細胞を作製し、シャーレ上で、細胞膜の修復異常の病態を確認しました。さらに、三好型筋ジストロフィー患者さんでは膜タンパク質の一種であるジスフェリン異常が知られていることから、三好型筋ジストロフィー患者さんのiPS細胞でジスフェリンを過剰発現させながら骨格筋細胞を作製すると、細胞膜の修復異常が緩和されました。
今回確立した筋肉細胞への分化方法を利用することにより、安定的に筋肉細胞を得ることができ、細胞膜の修復を検出する系も確立できたことから、今後、創薬への応用が期待されます。
この研究成果は2013年4月23日午後5時(米国東海岸時間)にオンライン科学誌「PLOS ONE」に掲載されました。
ポイント
- 再現性よくヒトiPS細胞から筋肉細胞を作製する方法を開発した。
- 三好型筋ジストロフィー患者さんのiPS細胞から筋肉細胞を作製し、病態を再現した。
- 今後、筋疾患における創薬開発のプラットフォームとして期待できる。
研究の背景
iPS細胞は、二つの大きな可能性があります。一つは、患者さんからiPS細胞をつくり、細胞レベルで病気の状態をシャーレ上で再現することです。これにより、さまざまな薬剤の効果を試し、治療法を開発することが期待されています。二つ目は、病気や怪我により失われた細胞の機能をiPS細胞から分化させた細胞により補うことです。細胞移植による再生医療も期待されています。これら二つの可能性を実現するための第一歩が、安定的に品質の良い分化細胞を得る方法の開発です。これまでに、報告されているヒトiPS細胞から骨格筋細胞を誘導する方法については、複雑で長期間を要したり、再現性に乏しかったり、効率が低いなどの問題を抱えていました。そこで、これらの問題を解決すべく、新たな骨格筋の分化誘導法開発に取り組みました。
研究結果
(1)新たな骨格筋細胞の分化誘導法を確立
まず、Doxycyclineに反応して目的の遺伝子を働かせることのできるベクターに、細胞の運命を骨格筋へと変えることのできる骨格筋分化制御因子MyoD1を組み込み、iPS細胞へと導入し、MyoD1を働かせている細胞集団を選択しました。次に、骨格筋へと分化誘導するための培養条件を検討し、最終的に、中胚葉を経ずに骨格筋細胞を約90%近くの効率で再現性よく得る方法を見出しました(Fig1左)。骨格筋細胞が生じていることの確認のため、細胞同士が融合するか、電気刺激により収縮するかなど、さまざまな方法で解析しました。結果的に、骨格筋細胞の分化誘導に必要な時間がこれまでの4~6週間から、2週間以内と短くなりました。
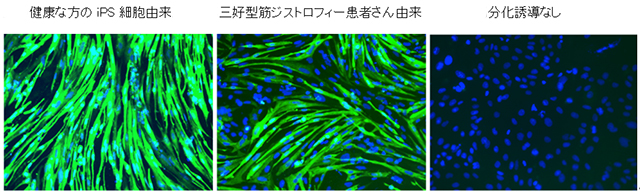
Fig1:ヒトiPS細胞から分化させた骨格筋細胞の写真(9日目)
分化誘導によって、左と真ん中の写真で緑色に光る筋肉細胞を確認できた。骨格筋細胞によくみられるミオシン重鎖(緑)、細胞核(青)
(2)三好型筋ジストロフィーの疾患再現
次に、三好型筋ジストロフィーの患者さん1人からiPS細胞株を二つ作製し、骨格筋細胞へと分化誘導させました(Fig1中央)三好型筋ジストロフィーは、骨格筋細胞の細胞膜が壊れやすくなるという症状がみられることから、今回誘導した患者さんiPS細胞由来骨格筋細胞の細胞膜の一点にレーザーをあて、細胞膜に穴を開けたところ、健康な方の場合に比べ、修復のスピードが遅くなることを確認しました(Fig2)。一方、三好型筋ジストロフィー患者さんではジスフェリンという膜タンパク質が欠損していることが知られているため、過剰に細胞内でジスフェリン遺伝子を働かせたところ、膜修復機能が回復することが明らかになりました。
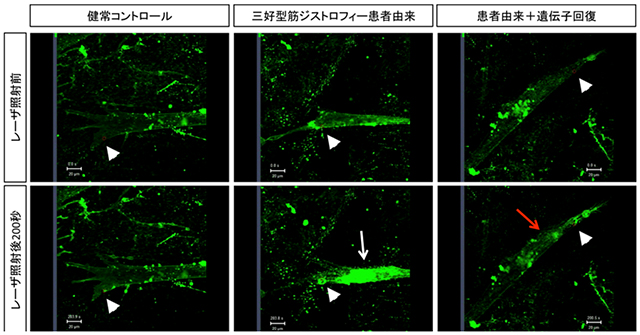
Fig2:三好型筋ジストロフィーの疾患再現実験
分化誘導により得られた骨格筋細胞にレーザーを照射し、細胞膜に穴をあけた(矢頭)。三好型筋ジストロフィー患者さん由来の骨格筋細胞では、穴がふさがらないため、本来細胞外に多く存在するはずの蛍光物質(緑)が細胞内に多く取り込まれてしまう(白矢印)。一方、患者由来のiPS細胞の遺伝子を強制発現によって回復された骨格筋細胞では、穴が早期にふさがるため、蛍光物質の取り込みが少なくなった(赤矢印)。
まとめ
今回の研究成果により、iPS細胞から骨格筋細胞を安定的に、効率よく、短期間で、分化誘導する手法が確立できました。これまで、安定的にiPS細胞を骨格筋細胞へと分化誘導する手法がなかったため、筋疾患を再現するのは難しい状況でしたが、今回、三好型筋ジストロフィーの病態をシャーレ上で再現することに成功しました。iPS細胞を用いた筋疾患の病態再現は、世界で初めての成果です。今後、三好型筋ジストロフィーに対する創薬スクリーニングへ発展させるとともに、骨格筋細胞の分化誘導法を他の難治性筋疾患に用いることで、多くの筋疾患に対する新たな治療法の開発、創薬につながると期待されます。
本研究は、以下の事業より資金的支援を受けて実施されました。
- 文部科学省「再生医療の実現化プロジェクト」
- 内閣府「最先端研究開発支援プログラム(FIRST)」
- 文部科学省「科学研究費補助金 若手研究B」
- 厚生労働科学研究費補助金(難治性疾患克服研究事業)
論文名、著者およびその所属
[DOI] http://dx.doi.org/10.1371/journal.pone.0061540
[KURENAIアクセスURL] http://hdl.handle.net/2433/173620
論文名
"Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro"
ジャーナル名
PLOS ONE 8(4): e61540
著者
Akihito Tanaka1,2, Knut Woltjen1, Katsuya Miyake3, Akitsu Hotta1, Makoto Ikeya1, Takuya Yamamoto1, Tokiko Nishino1, Emi Shoji1,4, Atsuko Sehara-Fujisawa4, Yasuko Manabe5, Nobuharu Fujii5, Kazunori Hanaoka6, Takumi Era7, Satoshi Yamashita8, Ken-ichi Isobe2, En Kimura8 and Hidetoshi Sakurai1* *)責任著者
著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 名古屋大学 大学院医学系研究科分子細胞免疫学
- 香川大学 医学部組織細胞生物学
- 京都大学 再生医科学研究所
- 首都大学 東京人間健康科学研究科
- 北里大学 理学部
- 熊本大学 発生医学研究所
- 熊本大学 大学院神経内科学
- 朝日新聞(4月24日夕刊 8面)、京都新聞(4月24日夕刊 1面)、産経新聞(4月24日夕刊 1面)、中日新聞(4月24日夕刊 1面)、日刊工業新聞(4月25日 28面)、日本経済新聞(4月24日夕刊 1面)、毎日新聞(4月24日夕刊 8面)および読売新聞(4月24日夕刊 2面)に掲載されました。

