2013年12月6日
江藤浩之 iPS細胞研究所(CiRA)教授、高山直也 オンタリオ癌研究所研究員(元CiRA助教)らの研究グループは、iPS細胞やES細胞に2種類の遺伝子(c-MYC、BCL-XL)を導入することで、試験管内でほぼ無限に増殖することの可能な赤血球前駆細胞を作製し、さらに成熟した赤血球へと分化させることに成功しました。この赤血球は胎児タイプのヘモグロビンを主体にしているものの、酸素運搬能やマウスへ輸血後に血液中に循環能を持っていることが確認できました。この技術は、ドナーの献血量に依存することなく安定的に赤血球を生み出せるため、将来、輸血の新たな選択肢として、輸血システムの安定化に役立つことが期待されています。
この研究成果は2013年12月5日正午(米国東部時間)に米国科学誌「Stem Cell Reports」のオンライン版に掲載されました。
ポイント
- ES細胞やiPS細胞から増殖能の盛んな赤血球前駆細胞を作製し、赤血球の大量生産に向けた方法を確立した。
- 今回作製した赤血球がマウス生体内で循環することを確認
- 今回開発した手法が、将来、安定的な赤血球の輸血供給システムの確立に役立つ可能性がある。
研究の背景
体中に酸素を運ぶ働きをもつ赤血球は、核をもたないため、自己増殖することができません。そのため、現在、深刻な貧血をもたらすような血液疾患の患者さんは、献血による血液製剤を用いた輸血に頼らざるを得ない状況です。しかしながら、献血ドナーの数は、少子高齢化などの原因により、減少しつつあります。安定的な輸血システムを構築するためにも、iPS細胞やES細胞などから、生体外で赤血球を大量に作製する技術の確立が期待されていますが、これまでのところ、輸血に用いることのできる量の赤血球の作製は報告されていません。
赤血球は生体内で造血幹細胞から造血前駆細胞、赤芽球を経て産生されます。また、造血前駆細胞からの分化過程で細胞核内の染色体が凝集し、そののちに核を失う(脱核)ことで、成熟した赤血球となります。一方、造血前駆細胞には自己増殖能があり、この自己増殖に関する因子を発見できれば、前駆細胞をほぼ無限に増殖させることができる可能性があります。本研究グループは既に、ほぼ無限に増殖することのできる巨核球(血小板を生み出す細胞)の作製に成功しており、赤血球についても同様にほぼ無限に増殖できる前駆細胞の作製に挑戦することにしました。
研究結果
(1)自己増殖できる赤血球前駆細胞株の作製
まず、ES細胞に対して、2種類の遺伝子(c-MYCとBCL-XL)を導入し、遺伝子発現の誘導開始後12日~24日に半固形培地上で安定的に増殖する細胞株を選択しました(図1)。得られた赤血球産生細胞株は不死化赤血球前駆細胞(immortalized Erythroblast Progenitor cell; imERYPC)と名付けられ、6ヶ月以上にわたって増殖し続けた上に、99%以上の細胞で赤芽球の細胞表面マーカーを確認することができました。iPS細胞においても、同様の結果が得られました。
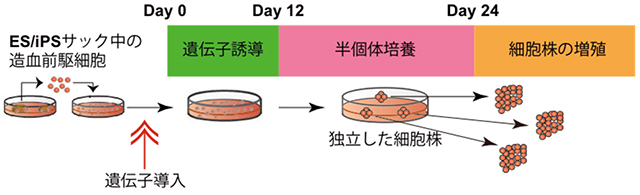
図1:不死化赤血球前駆細胞の作製方法
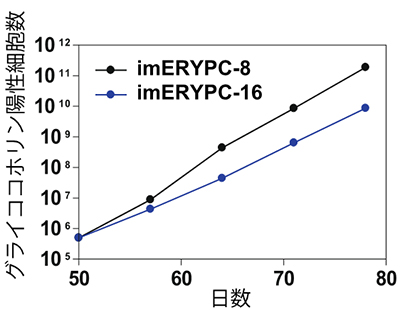
図2:不死化赤血球前駆細胞(immortalized Erythroblast Progenitor cell; imERYPC)株の増殖
imERYPC-8株とimERYPC-16株のどちらの細胞株も安定した細胞増殖をみせた。グライコホリンは、赤血球の細胞表面に存在するタンパク質
(2)自己増殖できる赤血球前駆細胞から誘導した赤血球は生体内同様の過程で分化することを確認
自己増殖できる不死化赤血球前駆細胞株は、導入した2種類の外来性遺伝子(c-MYCとBCL-XL)の発現誘導を人為的に止めると、7日で未成熟な赤芽球から成熟した赤芽球(染色体が凝集している)へと変化しました(図3)。また、赤く色づいたことから、酸素運搬に重要なヘム合成が起きていることがわかりました(図4)。
一方、2種類の外来性遺伝子(c-MYCとBCL-XL)の発現誘導を止めると、c-MYC遺伝子発現は1/10に低下するのに対し、BCL-XL遺伝子発現は20倍に増えました。これは、内在するBCL-XL遺伝子の影響と見られます。同時にヘム合成に重要な内在性のGATA1遺伝子やRAF1遺伝子の発現も増えていました。これらの結果は、不死化した赤血球前駆細胞から成熟した赤血球への分化過程の遺伝子発現は、生体内と同様であることを示しています。
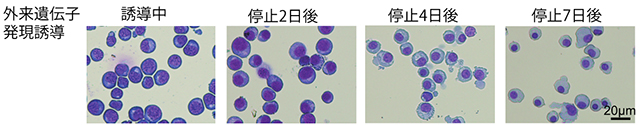
図3:外来性遺伝子発現誘導を止めた後の不死化赤血球前駆細胞の変化
染色した細胞を顕微鏡下で観察した。外来性遺伝子発現の誘導を停止した後、7日目には、染色体(濃い青)が凝集している様子がわかる。

図4:外来性遺伝子発現誘導を止めた後の細胞の色の変化
(3)脱核した赤血球が生体内で機能することの確認
次に生体内での赤血球の働きを調べるための系を確立しました。まず、放射線照射により貧血状態にしたマウスに対して、薬剤投与によりマクロファージを除去するなどの工夫を加え、24時間後に不死化した赤血球前駆細胞を腹腔内に注入しました。数日後、不死化赤血球前駆細胞の量を調べたところ、わずかではありますがマウス血液内を循環することが確かめられ、そのほとんどが脱核した赤血球となっていました(図5)。また、循環している不死化赤血球前駆細胞の割合が低いことの原因が、すみやかに分解されるためではなく、移植前に脱核している細胞の量が少ないためであることも明らかとなりました。
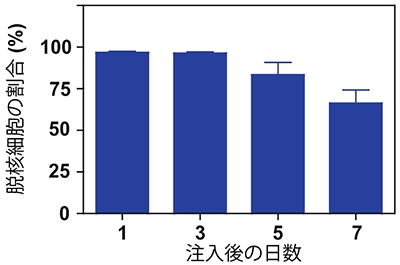
図5:不死化した赤血球前駆細胞株のうちマウス血液中で脱核していた細胞の割合
免疫不全マウスの血液中で循環していた細胞のほとんどが脱核していた。
まとめ
今回の研究では、c-MYC遺伝子の発現量が増えることにより、赤血球前駆細胞の増殖性が高まることに加え、BCL-XL遺伝子の発現量が赤血球前駆細胞の増殖過程よりも成熟過程で高いことが、赤血球の成熟を支えていることを示しました。c-MYC遺伝子とBCL-XL遺伝子は赤血球前駆細胞に内在することから、過去に開発されてきた癌ウイルス由来の人体に通常発現してない遺伝子を用いた赤血球の大量生産に比べ、生体内のしくみを模倣した手法であり、臨床応用を念頭に入れた場合にはより安全な手法であると言えます。本研究グループの試算では、通常の輸血1パックに必要な赤血球(1兆個)を作製するのに必要な培養液は、未分化なiPS細胞から直接分化する方法では、1,000~2,000リットルであるのに対し、今回開発した手法では、50~100リットルで十分となります。細胞を凍結保存した後に解凍した場合でも同様の結果が得られています。今後、より効率的な脱核方法や成人型のヘモグロビンのみをもつ赤血球を誘導する方法を確立すれば、赤血球輸血の安定供給に役立つのではと期待されます。
本研究は、下記機関より資金的支援を受けて実施されました。
- 文部科学省「再生医療の実現化プロジェクト」
- 文部科学省「科学研究費補助金」
- 内閣府「最先端研究開発支援プログラム(FIRST)」
書誌情報
[DOI] http://dx.doi.org/10.1016/j.stemcr.2013.10.010
論文名
"Immortalization of erythroblast by c-MYC and BCL-XL enables large-scale erythrocyte production from human pluripotent stem cells"
ジャーナル
Stem Cell Reports
Available online 5 December 2013
著者
Sho-ichi Hirose1, Naoya Takayama1, 2※, Sou Nakamura1, 2, Kazumichi Nagasawa3, Kiyosumi Ochi1, 2, Shinji Hirata2, Satoshi Yamazaki1, Tomoyuki Yamaguchi1, Makoto Otsu1, Shinya Sano1, Nobuyasu Takahashi4, Akira Sawaguchi4, Mamoru Ito5, Takashi Kato3, Hiromitsu Nakauchi1, and Koji Eto1, 2※
※責任著者
著者の所属機関
1. 東京大学 医科学研究所
2. 京都大学 iPS細胞研究所
3. 早稲田大学 先端生命医科学センター
4. 宮崎大学 医学部
5. 実験動物中央研究所
- 朝日新聞(12月6日 3面)、京都新聞(12月6日 31面)、産経新聞(12月6日 28面)、中日新聞(12月6日 32面)、日刊工業新聞(12月6日 23面)、日本経済新聞(12月6日 38面)、毎日新聞(12月6日 28面)および読売新聞(12月6日夕刊 12面)に掲載されました。

