2013年12月3日



左から尾野講師、堀江助教、西野大学院生
尾野亘 医学研究科講師、堀江貴裕 同助教、西野共達 大学院生らの研究グループは、脂肪酸とコレステロール合成の切り替えスイッチの発見に成功しました。この研究成果は、英国科学雑誌「Nature Communications」誌のオンライン版に掲載されました。
背景
マイクロRNA(miRNA、miR)は22塩基程度の小さなタンパクをコードしないRNAであり、標的メッセンジャーRNAの翻訳に抑制的に作用します。またマイクロRNAは発生や分化の過程のみならず、心血管疾患の発症や進展にも深く関与していることが知られています。
これまでに脂肪酸の合成とコレステロールの合成は同じアセチルCoAを原料として進むことが知られており、それぞれ特異的な転写因子sterol regulatory element-binding protein(SREBP;ステロール調節配列結合蛋白)-1とSREBP-2によって促進されることが示されてきました。これらのSREBPのクローニング、機能解析を行ったのは、Goldstein テキサス大学教授およびBrown 同教授(1985年ノーベル医学・生理学賞受賞者)の研究グループです。実際、彼らによって、SREBP-2が細胞内のコレステロールの低下を感知して合成および活性化され、コレステロール合成や取り込みに関わる遺伝子を上昇させて、細胞がコレステロール不足になることを防ぐことが証明されました。しかしながら、SREBP-1とSREBP-2の直接の相互作用については明らかではありませんでした。
2010年に、本研究グループを含む複数の研究グループによって、miR-33を抑制すると、その標的遺伝子であるATP-binding cassette transporter A1(ABCA1)が上昇し、HDLコレステロールが上昇することが報告されました。実際にmiR-33を抑制すると動脈硬化が改善するため、現在はmiR-33の抑制薬の研究開発が進められています。しかしながら、マイクロRNAは数百の標的遺伝子に作用することが知られており、長期的な完全なマイクロRNAの抑制がどのような結果を起こすかは全く不明です。
今回、本研究グループは、miR-33欠損マウスが肥満症と脂肪肝を呈することを見出し、その原因として、miR-33がSREBP-1を抑制する働きがあることを明らかにしました。miR-33はSREBP-2遺伝子のイントロンにあり、同時に発現されることから、SREBP-2はmiR-33を介してSREBP-1を抑制するという、直接の相互作用があることが示されました。すなわち、(1)コレステロール欠乏時にはSREBP-2とともにmiR-33が増加してSREBP-1を抑制することにより脂肪酸合成を低下させ、原料のアセチルCoAをコレステロール合成に使う。また、コレステロール過剰の際にはSREBP-1の抑制が解除されてアセチルCoAから脂肪酸合成が進むことになります。さらにこの知見は、(2)miR-33の抑制による動脈硬化治療の安全性を高める方法の開発につながると考えられます。
研究手法・成果
miR-33欠損マウスは加齢に伴い、肥満と脂肪肝を呈します。また高脂肪食を負荷すると、さらに早期より肥満が亢進し脂肪肝を呈します。このマウスの肝臓を用いたマイクロアレイ解析を行ったところ、脂肪酸代謝系の遺伝子群が発現上昇していました。データベースによる検討ではmiR-33の標的遺伝子にSrebf1(SREBP-1の遺伝子名)が存在しました。まず、培養細胞系において、Srebf1が標的遺伝子であることを確認した。実際にmiR-33欠損マウスの肝臓においてはSREBP-1が上昇していました。このSREBP-1の上昇が、miR-33欠損マウスの肥満および脂肪肝の原因になっているかどうかを検討する目的で、miR-33欠損マウスをSrebf1ヘテロマウスと交配し、miR-33欠損マウスのSREBP-1を正常マウスと同様のレベルまで低下させることを試みました。実際にこのマウス(miR-33-/-Srebf1+/-)においては、 SREBP-1のレベルが減少し、miR-33欠損マウスで認められた肥満が改善し(図1)、脂肪肝が改善しました(図2)。
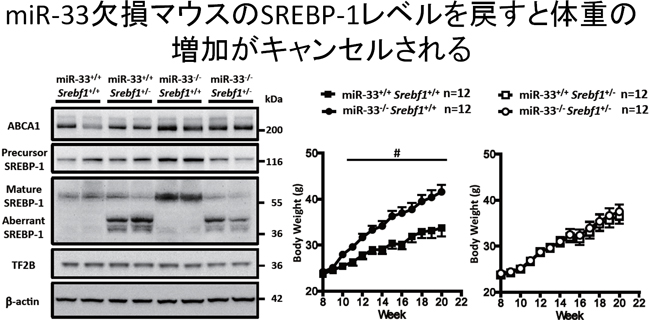
図1: miR-33欠損マウスのSREBP-1を正常マウスと同様のレベルまで低下させるとmiR-33欠損マウスで認められた肥満が改善した。
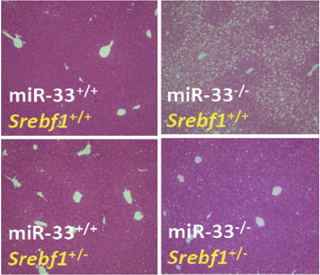
図2: 改善した脂肪肝
今回、miR-33欠損マウスが肥満症と脂肪肝を呈することを見出し、その原因として、miR-33がSREBP-1を抑制する働きがあることが判明しました。miR-33はSREBP-2遺伝子のイントロンにあることから、SREBP-2はmiR-33を介してSREBP-1を抑制するという、直接の相互作用があることが示されました(図3)。
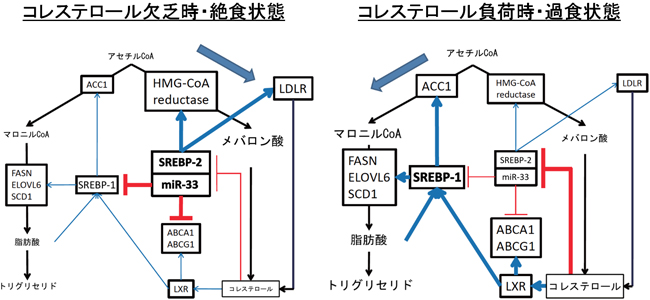
図3: コレステロール欠乏時はSREBP-2はmiR-33を介してSREBP-1を抑制する。また、コレステロール過剰時はSREBP-1の抑制が解除される。
波及効果
これまでに脂肪酸の合成とコレステロールの合成は同じアセチルCoAを原料として進むことが知られており、それぞれが特異的な転写因子sterol regulatory element-binding protein(SREBP; ステロール調節配列結合蛋白)-1(脂肪酸合成)とSREBP-2(コレステロール合成)によって促進されることが知られています。しかしながら、それら転写因子の直接の相互作用については明らかではありませんでした。今回の研究によって、脂肪酸合成とコレステロール合成の間に、マイクロRNAを介する直接の制御機構があることが初めて明らかになりました。このことにより、脂肪酸とコレステロールの制御機構の理解が深まるとともに、安全な動脈硬化治療法の開発につながると考えられます。
今後の予定
マイクロRNAは多くの標的遺伝子があるため、miR-33もまだ他の作用がある可能性があります。さらに詳細な解明を続けます。
用語解説
マイクロRNA(miRNA、miR)
22塩基程度の小さなタンパクをコードしないRNAであり、標的遺伝子のメッセンジャーRNAの翻訳に抑制的に作用する。
sterol regulatory element-binding protein(SREBP;ステロール調節配列結合蛋白)-1
脂肪酸の合成制御に関わる転写因子。遺伝子名はSrebf1
SREBP-2
コレステロールの合成制御に関わる転写因子
書誌情報
[DOI] http://dx.doi.org/10.1038/ncomms3883
[KURENAIアクセスURL] http://hdl.handle.net/2433/179546
Takahiro Horie, Tomohiro Nishino, Osamu Baba, Yasuhide Kuwabara, Tetsushi Nakao, Masataka Nishiga, Shunsuke Usami, Masayasu Izuhara, Naoya Sowa, Naoya Yahagi, Hitoshi Shimano, Shigenobu Matsumura, Kazuo Inoue, Hiroyuki Marusawa, Tomoyuki Nakamura, Koji Hasegawa, Noriaki Kume, Masayuki Yokode, Toru Kita, Takeshi Kimura & Koh Ono
"MicroRNA-33 regulates sterol regulatory element-binding protein 1 expression in mice"
NATURE COMMUNICATIONS 4, Article number: 2883 Published 03 December 2013
- 朝日新聞(12月4日 6面)、京都新聞(12月8日 28面)および日刊工業新聞(12月4日 17面)に掲載されました。

