2013年11月8日

左から岡村教授、Michel特定研究員
岡村均 薬学研究科教授、Jean-Michel Fustin 同特定研究員を中心としたグループは、哺乳類において、化学修飾されたメッセンジャーRNAが概日リズムの周期を決定していたことを解明しました。従来、遺伝子情報の発現では、DNAの転写または、タンパク質の化学修飾(リン酸化、アセチル化、メチル化、ユビキチン化など)が最重要であると考えられてきました。すなわち、RNAはDNAとタンパク質を結ぶ仲介役に過ぎないと思われてきたのです。しかし、今回の化学修飾されたRNA Methyl-6-adenosine (m6A)が24時間という長周期のリズム形成の主役であるという発見で、RNAが遺伝子発現の主役の一つだということが判明しました。今回の発見はエピトランスクリプトーム(epitranscriptome)の生理的意味を初めて解明した研究で、生体リズム研究を超えて、肥満や発癌のメカニズムの解明に大きな突破口を開くものと期待されます。
本研究成果が、「Cell」誌(日本時間2013年11月8日)に掲載されました。
背景
化学修飾は物質の性質を根本的に変え、多くの生物で、これを利用して多様な生命現象が営まれています。リン酸化、アセチル化、メチル化、ユビキチン化などがその主なものです。このうち、アセチル化は、主にタンパク質の性質を変化させる重要な反応で、多くの生理機能が知られていますが、核酸では用いられません。メチル化は広く、核酸、タンパク質、特にヒストンタンパク質で認められます。DNAのメチル化は、DNA中によく見られるCpGアイランドという配列の部分などで炭素原子にメチル基が付加する化学反応で、シトシンのピリミジン環の5位炭素原子へのメチル基の付加反応です。DNAメチル化は、不活性化されたクロマチン(サイレントクロマチン)を形成させる基本的には不可逆的な反応です。DNAメチル化の仕事が早く進んだのは、脱アミノ化のバイサルファイト法など、DNA修飾されたものを検出する手法が開発されたからですが、RNAに関してはそのような方法が開発されていなかったので、長らく研究が進みませんでした。
化学修飾をされたRNAがたくさんあることは、40年ほど前から言われていました。アデニンのプリン環の6位窒素原子へのメチル基の付加反応m6Aが初めて報告されたのは、1974年の肝癌細胞での研究です。ところが、検出法が煩雑なことと、RNAの寿命は非常に短いため、長い間ほとんど検索されてきませんでした。昨年、m6Aに対する抗体が開発され、それに次世代シークエンサーを組み合わせることで、m6Aが、数千もの機能遺伝子に存在すること、RNAの3'端近辺に多いことが報告されました(Meyer et al. Cell 2012; Dominissini et al. Nature 2012)。しかし、その生理作用はまったく分からないままでした。
今回、本研究グループは、体内時計の系でm6Aの機能を検討し、RNAのメチル化の状態で24時間という長周期が決められることを明らかにしました。すなわち、数ある生理現象や病態の中で、時計遺伝子のフィードバックループでリズムが生まれる体内時計において、はじめてエピトランスクリプトーム(epitranscriptome)の生理的意味が明らかとなったのです。
研究手法・成果
約24時間周期の体内時計(Biological Clock)は、地球の自転に対応した、生命にとってもっとも根源的な「時間」の仕組みであり、細胞の代謝、分裂増殖、老化と密に関係し、生体を活動期と非活動期(睡眠)という劇的な変動の中での恒常性システムの維持を日夜遂行しています。体内時計が注目されるもう一つの理由は、それがすべて時計遺伝子の転写・翻訳を介したフィードバック機構によって生み出されることです。リズム自身はこの転写ループで生み出されますが、なぜそれが24時間という周期なのかは分かっていませんでした。今回本研究グループは、mRNAのメチル化という反応が体内時計の周期の長さを決定していることを明らかにしました。この発見はメチル化阻害剤であるデアザアデノシン(DAA)の投与実験に始まります。DAAは、細胞でも、培養下でも、マウスの行動の個体レベルでも、体内時計の周期を大幅に延長させました(図1)。
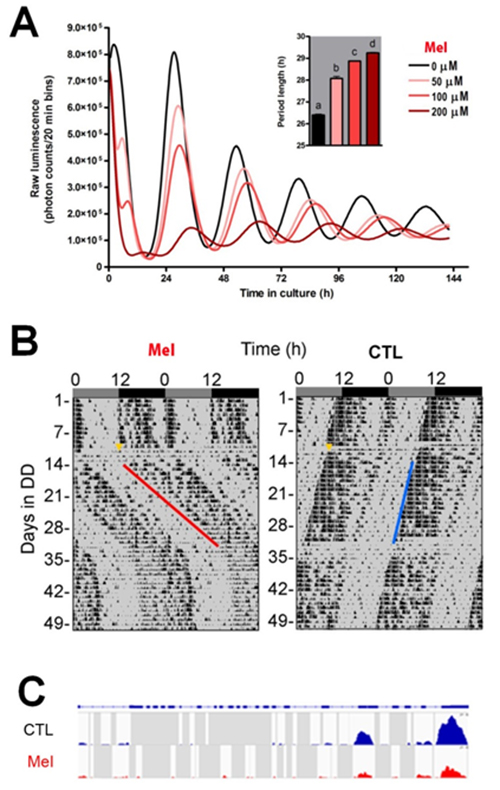
図1:メチル化阻害剤(MeI)投与にて細胞リズムの延長(Per2::luc MEF)(A)、脳室内投与にて行動リズム周期の延長(B)が惹起される。(C)ChIP-Seq解析で、3'末端近傍のRNAは大量にメチル化されており、これはDAAで強く阻害される。
よく知られたDNAや、ヒストンや非ヒストンタンパク質のメチル化の阻害はリズムの延長を誘導しないことから、RNAのメチル化が関与すると考えました。そこで本研究グループは今までまったくその生理機能が明らかでなかったmRNAのアデノシンN6位のメチル化(m6A)に注目し、この特異抗体を用いてRNA-Seq解析を行ったところ、時計遺伝子であるPer1、Per2、Bmal1のmRNAが高度にm6A化されていることがわかりました。さらに、m6Aメチル化酵素であるMettl3の発現をノックダウンさせると、このメチル化が大きく抑制され、その結果リズムが延長したのです。逆に、Mettl3を過剰発現させると、リズム周期は短縮しました。この結果は、時間生物学の分野にとっては、最近のゲノムワイドな大規模RNA-Seq解析によって提唱された転写後レベルのRNA制御によるリズム発生仮説(Koike, Science 2012)にも合致し、その具体的な分子機序を初めて明らかにしたものです。体内時計が24時間という周期を取るのはRNAレベルの制御が鍵だったのです(図2)。
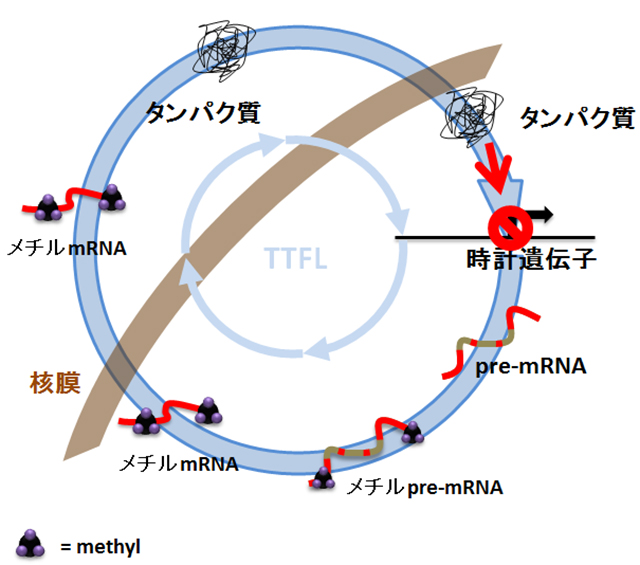
図2:エピトランスクリプトーム解析による24時間周期形成のモデル。時計遺伝子の転写翻訳フィードバックループTTFLにおけるRNAメチル化を示す。時計遺伝子は転写され、pre-mRNAはスプライシングを受けmRNAとなり、核外に移行し、翻訳される。m6Aメチル化により、これらのRNAプロセスは影響を受ける。RNAメチル化がPre-mRNAレベルで起こるのか、mRNAレベルでメチル化、脱メチル化反応が起こるのかは不明である。
研究の意義
今回の発見は、生体リズムの観点からだけでなく、RNAに関する見方を根本的に変えたものとして意味があります。今までの考えでは、RNAはDNAの遺伝情報を忠実に運ぶ運び屋に過ぎないと考えられてきたのです。RNAは糖(リボース)と塩基がリン酸を介して繋がった紐状のものですが、今回の研究は、RNAが転写された後、RNA塩基の一つであるアデニンの窒素に新たな化学修飾(メチル化)が負荷され、これにより新たな機能が生まれることを初めて明らかにした研究です。
RNAの核酸塩基が、A、U、G、Cの4塩基であることはどの高校教科書にも書いてあります。昨年の「Cell」と「Nature」に掲載された論文によると、塩基の一つであるアデニンが多くの部位でメチル化修飾を受けることが明らかになりました。すなわち、m6Aは20%ものヒト遺伝子に存在し、5000個以上のmRNA分子がm6A化されていることが、昨年ようやくわかったのです。しかし、その機能は今まで全く分っていません。
今回本研究グループは、時計遺伝子が転写レベルでリズムを形成する体内時計でのm6Aの機能を検討し、RNAのメチル化の状態で24時間という長周期が決められることを明らかにしました。すなわち、数ある生理現象や病態の中で、時計遺伝子のフィードバック制御でリズムが生まれる体内時計において、はじめてRNA修飾の生理的意味が明らかとなったのです。
このm6Aの機能解明は、RNA修飾を探求するエピトランスクリプトーム(epitranscriptome)の生理学的な意味を初めて明らかにしたもので、この分野の開始を告げる画期的な研究と言えます。RNA修飾は動的に制御されており、肥満、発癌などに関与する遺伝子にも多く見られます。今後は、今回チームを組んだ、次世代シークエンサー研究の眞鍋一郎 東京大学循環器内科講師、質量分析研究の掛谷秀明 薬学研究科教授のグループとともに、エピトランスクリプトームを用いた生活習慣病の原因解明と治療法の開発に取り組みたいと思います。
本研究は、主として文部科学省科学研究費補助金 特別推進研究、基盤研究(A)、新学術領域「脳内環境」によって行われました。
書誌情報
[DOI] http://dx.doi.org/10.1016/j.cell.2013.10.026
Jean-Michel Fustin, Masao Doi, Yoshiaki Yamaguchi, Hayashi Hida, Shinichi Nishimura, Minoru Yoshida, Takayuki Isagawa, Masaki Suimye Morioka, Hideaki Kakeya, Ichiro Manabe, Hitoshi Okamura
"RNA-Methylation-Dependent RNA Processing Controls the Speed of the Circadian Clock"
Cell Vol. 155, Issue 4, pp. 793-806 7 November 2013
- 京都新聞(11月23日 9面)に掲載されました。

