2013年9月3日
秋山芳展 ウイルス研究所教授、成田新一郎 同特定助教(現 盛岡大学栄養科学部准教授)、舛井千草 同大学院生は、堂前直 理化学研究所グローバル研究クラスタ先任技師(副主任研究員待遇)、鈴木健裕 同専任技師との共同で、大腸菌プロテアーゼBepAが外膜タンパク質の生合成と分解を促進することを発見しました。
本研究成果は2013年9月3日(米国東部時間)、米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版に掲載されました。
概要
外膜はグラム陰性細菌の生存に重要な働きを担っています。大腸菌のプロテアーゼBepAは外膜の品質管理への関与が示唆されていましたが、具体的な機能は不明でした。本研究ではBepAが、リポ多糖の輸送に関わる外膜タンパク質LptDの生合成を促進するとともに、生合成に失敗したLptDを分解することを明らかにしました。このようにBepAは外膜タンパク質の状態に応じて生合成と分解の二つの活性を使い分けることで、外膜の品質制御に寄与していると考えられます。BepAは細菌の薬剤耐性に関わるため、今後BepAを標的とした新たな抗菌薬の開発が期待されます。
背景
大腸菌などのグラム陰性細菌は細胞質膜(内膜)の外側にもう一つの膜構造(外膜)を持っています。外膜を構成する因子はすべて細胞質または内膜上で合成され、専用の輸送装置の働きで外膜まで輸送されます(図1)。外膜の機能が保たれていることはグラム陰性細菌の生存に重要であり、細菌は表層ストレス応答機構を備えて外的環境の変化に対応しています。大腸菌は複数の表層ストレス応答機構を備えていますが、中でもσE経路はもっとも重要なものの一つと考えられています。これまでに114の遺伝子がσEによる制御を受ける遺伝子(σEレギュロン)のメンバーとして同定されていますが、機能が明らかでない遺伝子も多く含まれています。細胞表層の品質管理機構を理解するため、これらの遺伝子の働きを解明することが求められています。σEレギュロンのメンバーであるyfgC遺伝子を欠失する大腸菌は多くの薬剤に対して感受性を示すことや、化学物質に対する感受性のプロファイリングから、yfgC遺伝子は外膜の生合成あるいは品質管理に働いていると考えられていました。今回、私たちはYfgCの機能解析を行い、YfgCが外膜タンパク質のアセンブリと分解を促進することを明らかにしました。この結果に基づき、私たちはYfgCをBepA (β-barrel assembly-enhancing protease)と改称することを提唱しました。
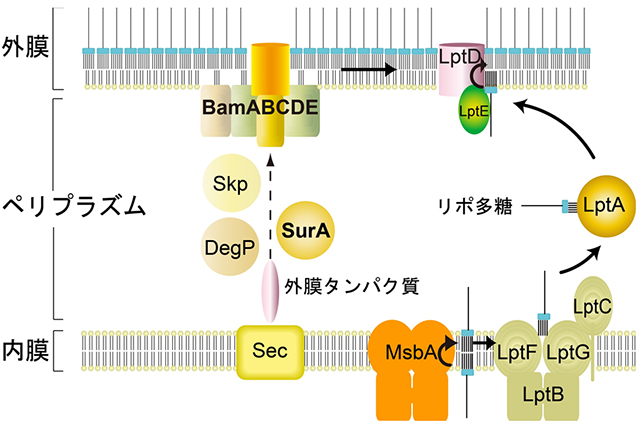
図1:外膜タンパク質とリポ多糖の外膜局在化機構
研究手法・成果
BepAは亜鉛メタロプロテアーゼの典型的な活性部位モチーフHEXXHを持っていますが、実際にプロテアーゼ活性を持つかどうかは不明でした。精製したBepAを用いてプロテアーゼ活性を調べたところ、BepAによるα-カゼインの切断が観察され、金属キレーターの添加やプロテアーゼ活性部位モチーフへの変異導入によって切断活性は阻害されました。また、BepAの活性部位モチーフ変異体はbepA欠失株の薬剤感受性を相補できず、野生株で発現させると薬剤感受性を亢進させました。これらの結果から、BepAのプロテアーゼ活性は細胞表層の機能維持に重要であると考えられます。一方、これらの変異体は特定の条件ではbepA欠失株の薬剤感受性を相補することから、BepAはプロテアーゼ活性に依存しない機能も持つと考えられました。
bepA欠失株の薬剤感受性を指標にマルチコピーサプレッサーを選択したところ、LptEの過剰発現によってbepA欠失株の薬剤感受性が抑制されることがわかりました。LptEはリポ多糖の輸送に関わる外膜タンパク質LptDの生合成に関与することが知られています。LptDは合成されると、Cys31-Cys173、Cys724-Cys725の2組のジスルフィド結合を持つ前駆体(LptDC)の状態で外膜にターゲットされ、LptEとの相互作用が引き金となってCys31-Cys724、Cys173-Cys725のジスルフィド結合を持つ成熟体(LptDNC)へと変換されます。bepA欠失株ではLptDCからLptDNCへの変換の遅延が見られたことから、BepAはLptDのジスルフィド結合の組換えを伴うフォールディングを促進すると考えられます(図2のA)。BepAのプロテアーゼ活性はこの反応に必須ではありませんが、十分な機能を発揮するために必要でした。また、LptEを枯渇させるとLptDCが蓄積しますが、これらはBepAによって分解されることも見出しました(図2のB)。さらに、光架橋能を持つ非天然型アミノ酸や化学架橋剤を用いた架橋実験、およびプルダウンアッセイの結果、BepAは外膜タンパク質の生合成に関与するBAM複合体と相互作用することもわかりました。BepAはペリプラズムシャペロンSurA欠損下では、BAM複合体の中心的構成因子BamAの分解に関わることも見出しました。以上の結果から、BepAはBAM複合体の近傍で外膜タンパク質のアセンブリを促進する一方、フォールディングが阻害された際はそれらを取り除く働きをするシャペロン/プロテアーゼであると考えられます。
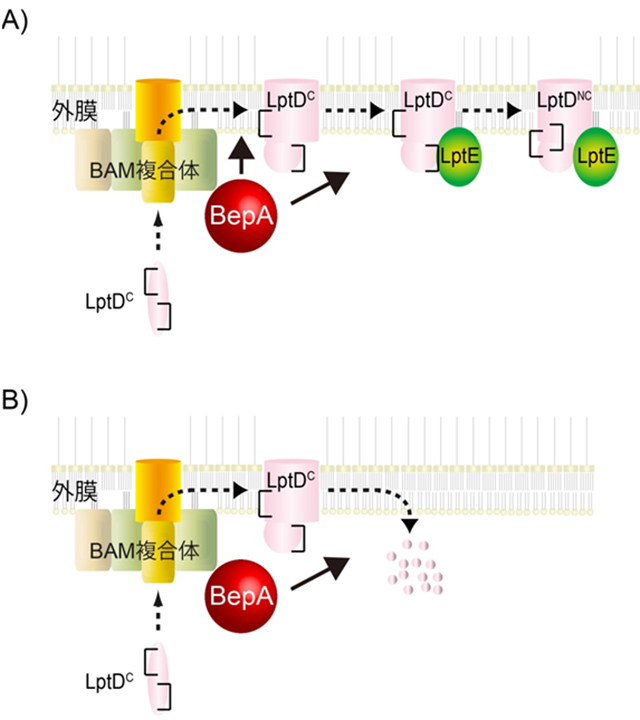
図2:外膜タンパク質LptDの生合成(A)と分解(B)におけるBepAの働き
波及効果
大腸菌や緑膿菌などのグラム陰性細菌の外膜はさまざまな薬剤に対して透過障壁として働いています。BepAを欠くことでリポ多糖の輸送が阻害されて外膜の機能が低下し、大腸菌がさまざまな抗菌薬に対して感受性を示すことが本研究により示唆されました。今後、BepAの活性を阻害する化合物のスクリーニング等を通して、新たな抗菌薬の開発につながることが期待されます。
本研究は、下記機関より資金的支援を受けて実施されました。
- 科学研究費補助金基盤研究(B)24370054「膜内タンパク質切断による新規な細胞機能調節機構の研究」 研究代表者:秋山芳展
- 学術研究助成基金助成金基盤研究(C)24570152「ストレス応答に関与するシャペロン/プロテアーゼを介した細菌細胞表層の品質管理機構」 研究代表者:成田新一郎
- 公益財団法人発酵研究所 平成24年度大型研究助成「細菌表層ストレス応答システムの新機能の解明」 研究代表者:秋山芳展
- 公益財団法人武田科学振興財団 2011年ライフサイエンス研究奨励「細胞表層タンパク質の品質管理に関わる新規ペリプラズムプロテアーゼの解析」 研究代表者:成田新一郎
用語解説
σE
σ因子は細菌RNAポリメラーゼと結合し、プロモーター領域の特異的な配列を認識することで、転写を開始する場所を決定する。大腸菌は7種のσ因子を持っており、σ70が主要σ因子であるのに対し、σEは表層ストレスなどによって活性化されてσE依存的プロモーターからの転写を開始する。
マルチコピーサプレッサー
遺伝子変異に起因する表現型が別個の遺伝子の変異によって抑制されるとき、後者をサプレッサーと呼ぶ。変異によらず他の遺伝子のコピーの増加による過剰発現によって抑制されるとき、これをマルチコピーサプレッサーと呼ぶ。サプレッサーとなる遺伝子は目的の遺伝子と関連する機能を持つことが推定される。
リポ多糖
脂質および多糖から構成される糖脂質で、グラム陰性細菌の外膜外葉に配置されている。リポ多糖は外膜がさまざまな物理化学的性質を持つ物質に対して透過障壁として働くために重要である。
ジスルフィド結合
タンパク質分子内/間のシステイン(Cys)残基間に形成される共有結合で、細菌ではペリプラズムで形成される。ジスルフィド結合の導入および異性化(組換え)にはDsbA, DsbCなどの酵素が働く。
シャペロン
分子シャペロンとも呼ばれる。細胞内でタンパク質の折り畳みや複合体形成の過程を助けるタンパク質(酵素)
書誌情報
[DOI] http://dx.doi.org/10.1073/pnas.1312012110
[KURENAIアクセスURL] http://hdl.handle.net/2433/178690
Protease homolog BepA (YfgC) promotes assembly and degradation of β-barrel membrane proteins in Escherichia coli
Shin-ichiro Narita, Chigusa Masui, Takehiro Suzuki, Naoshi Dohmae, and Yoshinori Akiyama.
Proc. Natl. Acad. Sci, USA, Published online before print September 3, 2013.

