2013年7月12日

左から長田教授、鈴木助教
アポトーシス(細胞死)を起こした細胞はマクロファージなどの貪食細胞に貪食されます。この際、死細胞は「eat me」シグナルとしてフォスファチジルセリンをその表面に暴露します。鈴木淳 医学研究科助教、長田重一 同教授、今西英一 同教務補佐員らのグループは、H. Robert Horvitz アメリカマサチューセッツ工科大学教授、Daniel P. Denning 同博士研究員のグループと共同で、このフォスファチジルセリン暴露の過程に関与している膜蛋白質を同定しました。
この研究成果は、2013年7月11日14時(米国東海岸時間)米国科学雑誌「Science」のon line版に発表されました。
概要
2重膜を形成している動物細胞の細胞膜で、フォスファチジルセリンやフォスファチジルエタノールアミンのリン脂質は膜の内側にのみ存在しますが、フォスファチジルコリンは外膜に多く存在します。この膜の非対称性は種々の局面で破綻します。例えば、出血により活性化された血小板はフォスファチジルセリンをその表面に暴露し、このフォスファチジルセリンが血液凝固因子を活性化、血液を凝固させます。一方、細胞がアポトーシス(細胞死)に陥るとフォスファチジルセリンが暴露され、これをマクロファージが死細胞からの「eat me」シグナルと認識し、死細胞を貪食します。リン脂質の非対称性を崩壊させる分子はスクランブラーゼ(Scramblase)と呼ばれていますが、その実体は明らかではありませんでした。本研究グループは2010年、8回膜貫通領域を持つTMEM16Fと呼ばれる蛋白質が、活性化された血小板でのフォスファチジルセリンの暴露に関与することを報告しました(鈴木助教ら Nature 468, 834, 2010)。今回、本研究グループは、アポトーシス時のフォスファチジルセリンの暴露に関与する分子を同定しました。
背景
2010年、鈴木助教はフォスファチジルセリンを強く暴露するマウス細胞株(Ba/F3-PS19)を樹立し、この細胞株からCa2+に応答してフォスファチジルセリンを暴露させる蛋白質(TMEM16F)を同定しました。そして、血友病の一種、Scott Syndromeと呼ばれる患者はこの遺伝子に変異を持つことを示しました。実際、TMEM16F遺伝子を欠損したマウス細胞ではCa2+に依存したリン脂質のスクランブリングは全く起こりませんでした。一方、アポトーシス時のリン脂質のスクランブリング、フォスファチジルセリンの暴露はTMEM16F欠損細胞でも、野生型の細胞と同じ効率で進行しました。このことから、アポトーシス時にリン脂質のスクランブリングを引き起こす分子は別に存在すると考えられました(鈴木助教ら J. Biol.Chem.288, 13305, 2013)。
研究手法と成果
そこで、鈴木助教は上記Ba/F3-PS19細胞株からのcDNAライブラリーを再度スクリーニング、フォスファチジルセリンを暴露させる能力を持つcDNAを単離しました。単離されたcDNAはXkr8と呼ばれる6個の膜貫通領域を持つ膜蛋白質をコードしていました(図1)。マウスT-リンパ球株WR19LにこのcDNAを発現させると、Fasリガンドによるアポトーシス時のフォスファチジルセリンの暴露が顕著に増強されました。一方、Xkr8遺伝子をノックアウトしたマウスから樹立した繊維芽細胞ではアポトーシス時のフォスファチジルセリンの暴露が完全に失われました。スクランブラーゼは、フォスファチジルセリンばかりでなく、他のリン脂質の外膜、内膜の移動も促進するとされています。実際、Xkr8を発現する細胞にアポトーシスを起こすと、フォスファチジルセリンばかりでなく、フォスファチジルエタノールアミンも細胞外に暴露され、また通常は外膜に存在するフォスファチジルコリンが内膜へと移動しました。ところで、Xkr8は線虫のCED8と呼ばれる遺伝子とそのアミノ酸配列が20%相同です。Horvitz教授らは、CED8を欠損した線虫ではアポトーシスを起こした細胞の表面にフォスファチジルセリンが暴露されないことを確認しました。以上より、Xkr8/CED8はアポトーシス時、リン脂質を内膜、外膜の間でスクランブリングさせる過程に関与していると結論づけました。
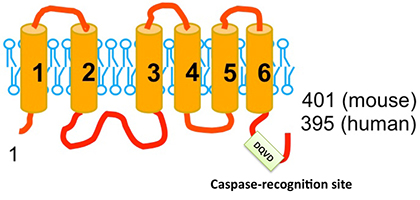
図1:Xkr8の構造とカスパーゼ認識配列
それでは、Xkr8はアポトーシス時にどのように活性化されるのでしょうか。アポトーシスはカスパーゼと呼ばれる蛋白質分解酵素によって実行されますが、フォスファチジルセリンの暴露もカスパーゼを阻害すると起こりません。そこで、Xkr8蛋白質のアミノ酸配列にカスパーゼの認識配列が存在しないかを調べると、ヒトやマウスのXkr8蛋白質のC-末端近傍にカスパーゼ3によって切断される配列が認められました(図1)。そして、実際、アポトーシス時にこの蛋白質が切断されること、切断されない変異体ではリン脂質をスクランブリングできないことを見いだしました。すなわち、Xkr8は健康な細胞内では活性のない前駆体として存在し、アポトーシスが誘導されるとカスパーゼにより切断、活性のある蛋白質に変換されると結論づけました。
アポトーシス時のフォスファチジルセリンの暴露はほとんどの細胞で起こりますが、ある種のヒト白血病細胞(RajiやPLB985細胞)ではフォスファチジルセリンは暴露されず、マクロファージがその死細胞を貪食することもありません。そこで、これら白血病細胞でのXkr8遺伝子を調べたところ、その遺伝子構造は正常であるにも関わらず、ほとんど発現されていませんでした。一方、Xkr8遺伝子のプロモーターはCGに富んでおり(CpG islands)、RajiやPLB985白血病細胞では健常人の白血球細胞と異なり、そのシトシン塩基が高い頻度でメチル化されていました(図2)。このことから、これらヒト白血病細胞ではXkr8遺伝子のプロモーターのCpG残基がメチル化され、これによってその発現が抑制されていると結論しました。実際、PLB985細胞を脱メチル化試薬DAC(5'-aza-2'-deoxycytidine)で処理するとプロモーター領域のメチル基は除去され、Xkr8遺伝子が発現、アポトーシス時のフォスファチジルセリンの暴露も観察されました。
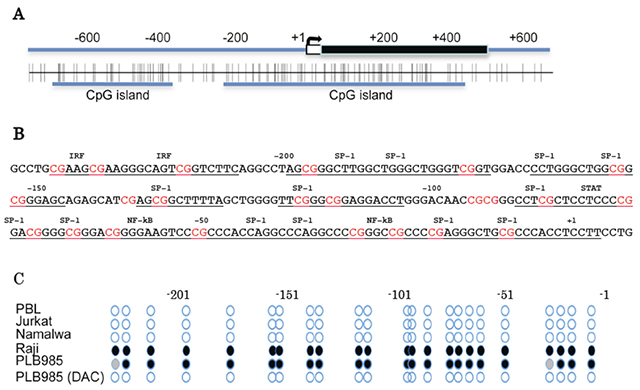
図2:ヒトXkr8遺伝子プロモーター領域のCpG islandsと白血病細胞でのメチル化
A:ヒトXkr8 遺伝子プローモーター領域のCpG配列を縦線で示した。B:ヒトXkr8遺伝子プロモータの塩基配列と転写因子認識部位。C:ヒトXkr8遺伝子プロモーター領域(-230から+1)におけるCpG配列のメチル化状態を示した。○:メチル化無し、●:90%以上の確率でメチル化
今後の課題
今回本研究グループは、アポトーシス細胞において「eat me」シグナルとして作用するフォスファチジルセリンの暴露に関与する膜蛋白質(Xkr8)を同定しました。この蛋白質は増殖している細胞中では活性のない前駆体として存在し、アポトーシスがおこるとカスパーゼによって直接、切断活性化されます。フォスファチジルセリンは貪食細胞が死細胞を貪食するためのシグナルであり、フォスファチジルセリンが提示されないと、死細胞は貪食されず、細胞膜が破裂、いわゆるネクローシス状態に陥ると考えられます。ネクローシスに陥った細胞からは核やDNA、ミトコンドリアなどが放出され、自己抗体の産生を介して、SLE(Systemic Lupus Erythematosus、全身性エリテマトーデス)様の自己免疫疾患を発症させる可能性があると思われます。SLEなどのヒトの自己免疫疾患がXkr8遺伝子の作用不全で起こっているかどうかを調べる必要があります。ところで、ある種のがん細胞において、がん抑制遺伝子の発現がその遺伝子プローモーターに存在するCpG islandsのメチル化によって抑制されていることが知られています。今回、本研究グループは2種のヒト白血病細胞でXkr8遺伝子のプロモーターがメチル化され、その発現が抑制されていることを見いだしました。このようながん細胞はアポトーシスに陥っても貪食されず、ネクローシスに陥った細胞から放出された細胞内分子により、強い炎症反応が惹起される可能性があります。このことががんの進行を引き起こす可能性がないかどうかが今後の課題です。最後に、Ca2+に応答してリン脂質をスクランブルするTMEM16Fとアポトーシス時に作用するXkr8はアミノ酸配列は全く異なっています。これらの分子がどのようにリン脂質をスクランブルさせるのか、その分子機構は大変興味深いものです。
本成果は、文部科学省科学研究費 特別推進研究「マクロファージによる死細胞貪食・分解の分子機構」および科学技術振興機構戦略的創造研究推進事業(CREST) 研究領域「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」(菅村和夫研究総括)の研究推進過程で得られたものです。
書誌情報
[DOI] http://dx.doi.org/10.1126/science.1236758
[KURENAIアクセスURL] http://hdl.handle.net/2433/176304
Suzuki Jun, Denning Daniel P., Imanishi Eiichi, Horvitz H. Robert, Nagata Shigekazu.
Xk-Related Protein 8 and CED-8 Promote Phosphatidylserine Exposure in Apoptotic Cells.
Science, Published online 11 July 2013
- 京都新聞(7月12日 25面)、中日新聞(7月12日 3面)および日刊工業新聞(7月12日 21面)に掲載されました。

