2013年6月25日
小川誠司 医学研究科教授、本間之夫 東京大学医学系研究科(医学部附属病院)教授、宮野悟 同医科学研究所ヒトゲノム解析センター教授、嘉村巧 名古屋大学理学研究科教授、油谷浩幸 東京大学先端科学技術研究センター教授、菅野純夫 同新領域創成科学研究科教授、深山正久 同医学系研究科教授、角田達彦 理化学研究所ゲノム医科学研究センターチームリーダー、佐藤悠佑 東京大学医学系研究科大学院生、吉里哲一 同大学院生、眞田昌 医学研究科助教らのグループは共同研究で、腎臓癌における遺伝子異常の全体図を解明しました。
本研究成果は、2013年6月24日(米国東部夏時間)に米国科学雑誌「Nature Genetics」電子版にて公開されました。
概要
淡明細胞型腎細胞癌は腎臓に発生する癌のうちおよそ80%を占める代表的な腎臓癌です。現在のところ、手術による切除以外には完全な治癒を期待できる治療法がありません。癌が進行し転移を生じた場合には免疫療法や分子標的薬による治療が行われますが、その効果は限定的であり、より有効かつ身体への負担が少ない、新たな治療法の開発が求められています。そのためには、遺伝子変異をはじめとして、癌細胞で後天的に生じているゲノム異常・分子病態を詳細に理解する必要があります。
今回、本研究チームは、東京大学医学部附属病院泌尿器外科(本間教授)との緊密な共同研究によって、同科で長年にわたり集積された100例を超える腎細胞癌症例を対象として、全ゲノムシーケンス解析を含む最先端の遺伝子解析技術を駆使して淡明細胞型腎細胞癌の統合的分子解析を行い、遺伝子異常の全体図を明らかにしました。本解析は、淡明細胞型腎細胞癌について行われたものの中では、これまでで最大規模の統合的解析の一つであり、淡明細胞型腎細胞癌の分子病態の解明に大きな進展をもたらしました。
本研究のポイント
- 100例を超す淡明細胞型腎細胞癌における遺伝子変異・ゲノム構造変化・DNAメチル化修飾・遺伝子発現変化を網羅的に明らかにした。
- 淡明細胞型腎細胞癌がゲノム異常に基づいて複数のサブグループに分類できること
- メチル化状態により分類される三つのサブグループは生命予後を反映する。
- 淡明細胞型腎細胞癌における新規変異遺伝子が多数同定された。
- VHL異常を有さない症例においてVHLと複合体を形成するTCEB1(elonginC)に変異が同定された。
- TCEB1に変異が生じることによりVHLと複合体が形成できず、VHL異常と同様にHIFタンパクが細胞内に蓄積される。
背景
淡明細胞型腎細胞癌は腎臓に発生する癌のうちおよそ80%を占める代表的な腎臓癌です。近年は健康診断で偶然に発見されることも増えていますが、進行するまで自覚症状が出にくいため、転移をきたしてから診断されることも少なくありません。手術による切除以外には完全な治癒を期待できる治療法は現在のところなく、転移を生じた場合、治療に難渋する症例が多いことが大きな問題点とされています。転移例に対しては、インターフェロン等を用いた免疫療法に加え、近年では分子標的薬による治療が行われていますが、癌が消失することは稀であり、その効果は限られたものと言えます。淡明細胞型腎細胞癌の治療成績を向上させるためには、遺伝子変異をはじめとして、癌細胞で生じているゲノム異常・分子異常を詳細に理解し、どのようなゲノム異常・分子異常が癌の発生や進行に関わっているかを検討する必要があります。そのためには、単一の方法による解析のみでは不十分であり、遺伝子変異の解析だけでなく、多彩なアプローチによる統合的な解析を行う必要があります。
今回、本研究チームは、東京大学医学部附属病院泌尿器外科(本間教授)で長年にわたり集積された100例を超す淡明細胞型腎細胞癌における遺伝子変異・ゲノム構造変化・DNAメチル化修飾・遺伝子発現変化を網羅的に明らかにしました。本解析は、淡明細胞型腎細胞癌について行われたものの中では、これまでで最大規模の統合的解析であり、淡明細胞型腎細胞癌の分子病態の解明に大きな進展をもたらしました。
研究手法・成果
次世代シークエンサーとスーパーコンピュータによる塩基配列の解読
癌細胞において生じている遺伝子異常は、症例によっても大きく異なるため、淡明細胞型腎細胞癌における遺伝子変異のプロファイルを明らかにするためには、多数の症例を対象として、網羅的にゲノムの塩基配列を解読することが重要です。そこで、東京大学医学部附属病院泌尿器外科(本間教授)で診断・治療された患者検体を用いて、14例について30億塩基対からなるゲノム全体の塩基配列を、106例についてゲノムのうちタンパク質をコードする領域(エクソン)の全塩基配列を解読することにより、淡明細胞型腎細胞癌で生じている遺伝子変異を同定しました。変異の同定には、次世代シークエンサーによる塩基配列情報の収集と、スーパーコンピュータによる高速度のデータ解析を行いました。
その結果、淡明細胞型腎細胞癌では、1例あたり平均、ゲノム全体では5,100個、エクソン領域では約50個の遺伝子変異が検出されました(図1)。
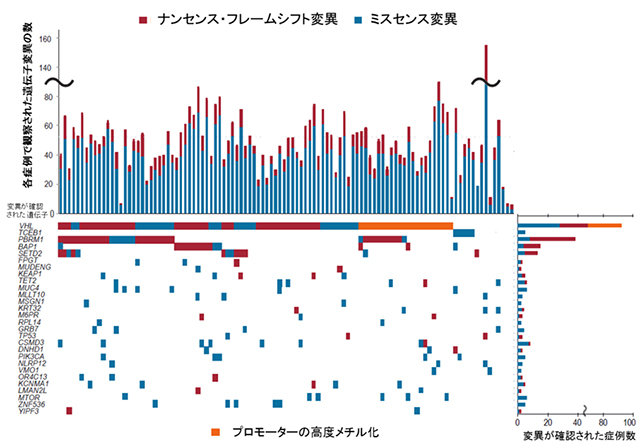
図1:106例の全エクソン解析において同定され、有意と考えられた遺伝子変異
1例あたり平均50個の変異が観察されるが、その多くは、1例でのみ観察される異常であり、意義は不明である。VHL、PBRM1、BAP1、SETD2を除く遺伝子変異の多くは、今回、新規に腎細胞癌で同定された遺伝子変異であり、新規に同定されたTCEB1変異はVHL遺伝子と排他的に観察される。
淡明細胞型腎細胞癌において新たに発見された遺伝子変異
癌は遺伝子異常に基づいて発症をしますが、淡明細胞型腎細胞癌では、VHLという遺伝子の異常が極めて高頻度に存在することが知られています。VHL遺伝子がコードするVHLタンパクはいくつかのタンパク質(Elongin BやElongin Cなど)と複合体を形成し、HIF(低酸素誘導因子)タンパクの分解を促し、正常細胞ではHIFのタンパク量が調整されています(図2)。VHL遺伝子に異常が生じるとHIFが分解されなくなり、蓄積することが発癌に関わると考えられています。今回の研究でも、92%の症例でVHL遺伝子の異常が検出されました。これまで、VHL異常が認められない症例において、どのような遺伝子異常が生じているのか不明でしたが、研究チームはこれらの症例の半数近くでTCEB1という遺伝子に変異が生じていることを、世界で初めて明らかにしました。TCEB1遺伝子はElongin Cをコードしており、VHLとともにHIFの分解に関わっています。興味深いことに、TCEB1(Elongin C)の変異は特定の2か所のアミノ酸に集中していました(図2)。研究チームは、このアミノ酸に変異が生じて他のアミノ酸に置換されると、Elongin CとVHLの結合が阻害され、これによりHIFが分解されず蓄積することを明らかにしました。
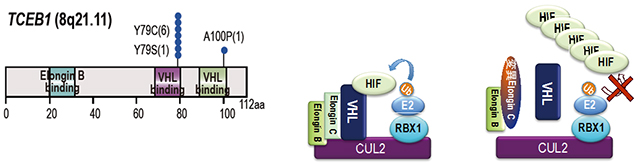
図2:TCEB1(Elongin C)の変異
VHL分子との結合に重要な特定のアミノ酸に集中して生じる(左)VHLはElongin BやElongin Cと複合体を形成し、ユビキチン化を介したHIFの分解を促す(中央)TCEB1(Elongin C)に変異が生じると、VHLとの複合体が形成されず、HIFが分解されず、蓄積する(右)。
その他にも、DNAの脱メチル化を調節する働きを持つTET2遺伝子や、酸化ストレス反応に関わるKEAP1/NRF2/CUL3遺伝子の変異も同定されました。これらの遺伝子変異は、他の癌腫において変異が生じていることが知られていますが、腎癌における変異は、本研究で初めて明らかとなりました。また、PBRM1、BAP1、SETD2など、クロマチン修飾に関わる遺伝子変異が高頻度に検出され、BAP1の変異例は死亡のリスクが高いこと、SETD2の変異例は転移のリスクが高いこともわかりました。これらの遺伝子変異が明らかとなったことで、今後新たな薬剤の開発につながることが期待されます。
淡明細胞型腎細胞癌における最大規模の統合的解析
本研究では、遺伝子変異の同定だけではなく、染色体数の異常(コピー数異常)、遺伝子の機能の量的な異常(遺伝子発現)およびエピジェネティックな異常(DNAのメチル化)についても100例以上の症例を用いて網羅的な解析を行いました(図3)。腎癌において、多数症例を用いて各種の解析を統合的に施行した研究は過去になく、これまでで最大規模の研究であり、非常に意義深いものです。
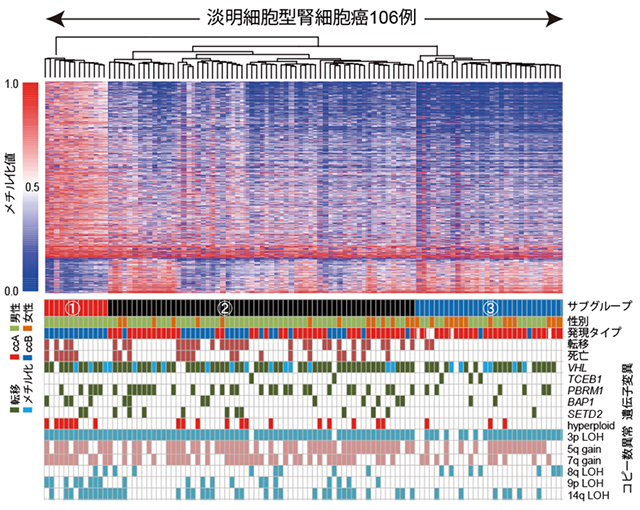
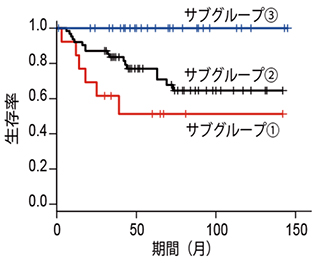
図3:淡明細胞型腎細胞癌106症例における統合的ゲノム解析
メチル化状態に基づき分類された3グループは、生命予後が大きく異なる。サブグループ(3)では、本解析においては観察期間中、死亡例が観察されておらず予後が極めて良好である。一方サブグループ(1)では、慎重な経過観察ならびに積極的な治療が検討される。
ゲノム異常のプロファイルによる腎細胞癌の分類
各種の解析を同時に行うことにより、遺伝子変異、コピー数異常、遺伝子発現の変化、DNAのメチル化の状態には、それぞれ密接な関連があることがわかりました。また、これらのゲノム異常のプロファイルから、淡明細胞型腎細胞癌が複数のサブグループに分類できることが明らかになりました。いくつかのゲノム異常は生命予後や再発などの臨床病型と相関をしており、特にメチル状態による分類は予後予測に有用である可能性があります。
波及効果
本研究では、多数の症例を対象とし、遺伝子変異の同定をはじめとする多彩なアプローチから、淡明細胞型腎細胞で生じているゲノム異常のプロファイリングを詳細に解明しました。近年の遺伝子解析技術の進歩に伴い、大規模な遺伝子解析研究が欧米を中心に行われつつありますが、統合的な解析は非常に限られています。本研究は、腎細胞癌においては他に類を見ない大規模な研究であり、その成果が我が国から発信されることは非常に意義深いものです。淡明細胞型腎細胞癌で生じているゲノム異常・分子異常を完全に解明したことにより、この癌に関するあらゆる研究の進展に寄与するものと期待されます。今後の研究により、淡明細胞型腎細胞癌の新たな分類方法や治療法の開発はもちろん、ゲノム異常に基づいた治療法や薬剤の選択、すなわちオーダーメイド医療の実現がより進むことが期待されます。
今後の予定
本研究は、将来的に淡明細胞型腎細胞癌の診断・治療の現場に成果が還元されることによって、さらに有意義なものになります。今回の知見をもとに、臨床への応用の実現性を検討しながら、新しい治療法の開発を目指すなどの、さらなる研究が必要になります。
本研究は、文部科学省科学研究費補助金 新学術領域研究「システム的統合理解に基づくがんの先端的診断、治療、予防法の開発」(領域代表者:宮野教授、計画研究代表研究者:小川教授)、内閣府/日本学術振興会 最先端研究開発支援プログラム「未解決のがんと心臓病を撲滅する最適医療開発(中心研究者:永井良三 自治医科大学学長)」により行われました。
用語解説
ゲノム
ある生物のもつ全ての遺伝情報、あるいはこれを保持するDNAの全塩基配列。タンパク質のアミノ酸配列をコードするコーディング領域とそれ以外のノンコーディング領域に大別される。
エピジェネティック
DNAの塩基配列情報の変化を伴わずに遺伝子の発現や細胞の様態が変化する機構。DNAのメチル化や脱メチル化による遺伝子発現の制御が代表的
書誌情報
[DOI] http://dx.doi.org/10.1038/ng.2699
Sato Yusuke, Yoshizato Tetsuichi, Shiraishi Yuichi, Maekawa Shigekatsu, Okuno Yusuke, Kamura Takumi, Shimamura Teppei, Sato-Otsubo Aiko, Nagae Genta, Suzuki Hiromichi, Nagata Yasunobu, Yoshida Kenichi, Kon Ayana, Suzuki Yutaka, Chiba Kenichi, Tanaka Hiroko, Niida Atsushi, Fujimoto Akihiro, Tsunoda Tatsuhiko, Morikawa Teppei, Maeda Daichi, Kume Haruki, Sugano Sumio, Fukayama Masashi, Aburatani Hiroyuki, Sanada Masashi, Miyano Satoru, Homma Yukio, Ogawa Seishi.
Integrated molecular analysis of clear-cell renal cell carcinoma.
Nature Genetics, 2013/06/24/online
- 京都新聞(6月25日 28面)、産経新聞(6月26日 22面)、日本経済新聞(6月25日 42面)および毎日新聞(6月25日夕刊 9面)に掲載されました。

