2013年4月1日
本学、高輝度光科学研究センター(JASRI)、スタンフォード大学(Stanford Univ., USA)、ミネソタ大学(Univ. of Minnesota, USA)、Advanced Photon Source(USA)、九州大学は共同で、大型放射光施設SPring-8の核共鳴散乱ビームライン(BL09XU)の高輝度X線を利用することにより、自然界において重要な酸化反応を促進する触媒である二核非ヘム鉄酵素の高原子価鉄-オキソ中間体の分子振動構造の解明に成功しました。
二核非ヘム鉄酵素において生成する高原子価鉄-オキソ中間体は極めて高い酸化反応性をもち、人工分子触媒では困難な化学反応を実現することが知られています。したがって、生化学的な重要性のみならず工業化学の観点からも、二核非ヘム鉄酵素の高原子価鉄-オキソ中間体の分子構造とその高酸化反応メカニズムの解明が望まれていました。
本研究では、核共鳴非弾性散乱分光法(NRVS)により、二核非ヘム鉄活性中心において生成した高原子価鉄-オキソ中間体の低振動モードが、二核非ヘム鉄中心の架橋構造および非ヘム鉄イオンのスピン状態に依存し、その鉄中心の酸化状態には強く影響されないことを明らかにしました。今回の高原子価鉄-オキソ中間体の分子振動構造の解明により、抗がん剤やバイオ燃料の開発に向けた基礎研究が飛躍的に進展するものと期待されます。
本研究成果は、2013年4月1日(アメリカ時間)の米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」のオンライン速報版で公開されました。
研究の背景
二核非ヘム鉄イオンを活性中心に含むリボヌクレオチドリダクターゼ(RNR)および可溶性メタンモノオキシゲナーゼ (sMMO) は、それぞれチロシンのO-H結合の活性化、およびメタンのC-H結合の活性化を促進することが知られています。これらの化学結合は非常に強固であり、熱力学的に困難な化学反応であることが知られていますが、これらの二核非ヘム鉄酵素は温和な生理的条件下で反応を促進することが知られており、その反応の分子メカニズムの解明が望まれています。その酸化反応を実現する反応中間体の構造として、{Fe2(μO)2}ダイアモンドコア構造、プロトンが付加したダイアモンドコア構造、あるいは単核鉄オキソ構造が提案されていますが、未だに決定的な科学的証拠は得られていません。これら中間体の構造的特性について原子レベルで理解することは、医学や工業化学への応用に向けた基礎研究として極めて重要です。
注)振動分光法は分子構造解析に有用で、振動分光法の一つであるラマン分光法はその強力な手法として用いられてきました。しかしながら、比較的強いレーザー光照射を必要とするラマン分光法は、酵素において生成する不安定化学種が光照射により分解するために用いることが困難であること、また、分光学的選択則により全ての振動モードを観測することが不可能であるといったデメリットがあります。一方で、大型放射光の利用が不可欠な57Fe核共鳴非弾性散乱分光法(NRVS)はラマン分光法を代替する手法として、近年盛んに鉄含有金属酵素の分子構造解析に用いられています。
研究の成果
構造的性質がよく理解された一つもしくは二つの酸素原子が架橋した高原子価二核鉄中心(Fe(III)Fe(IV)およびFe(IV)2)構造をもつ二核非ヘム鉄モデル酵素錯体(図1)の分子振動構造をNRVSにより解析しました。これらの化学種は450cm-1以下の領域に特徴的な振動構造をもちますが、それらは鉄イオンの酸化数の変化に対して影響を受けませんが、鉄イオンのスピン状態および酸素原子の架橋構造の違いにより顕著に影響が現れることを見いだしました。一酸素原子が架橋した低スピン状態の二核非ヘム鉄モデル酵素錯体は450cm-1以下の領域に三つのバンドを示しますが、二酸素原子が架橋した低スピン二核鉄錯体においては五つのバンドが観測され、それらは酸素原子が架橋した二核鉄面内の並進および回転の動きを含む振動構造であることを明らかにしました(図2)。さらに、密度汎関数法計算(DFT)計算により低スピンから高スピン状態に変化する際に、反結合性σ軌道の相互作用が強くなり、反結合性π軌道相互作用が弱まることを明らかにし、高スピン状態の一酸素原子架橋構造においては二酸素原子架橋構造と比べて、バンドの分裂がさらに大きくなることを明らかにしました(図3)。
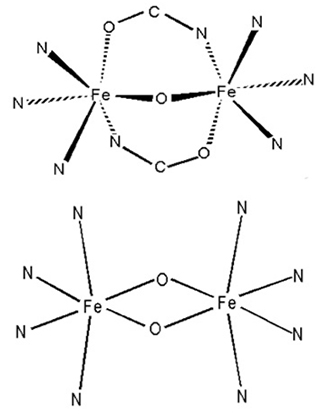
図1:一酸素原子架橋した2核非ヘム鉄酵素錯体(上)と二酸素原子架橋した2核非ヘム鉄酵素錯体(下)。Fe:鉄原子、O:酸素原子、N:窒素原子、C:炭素原子
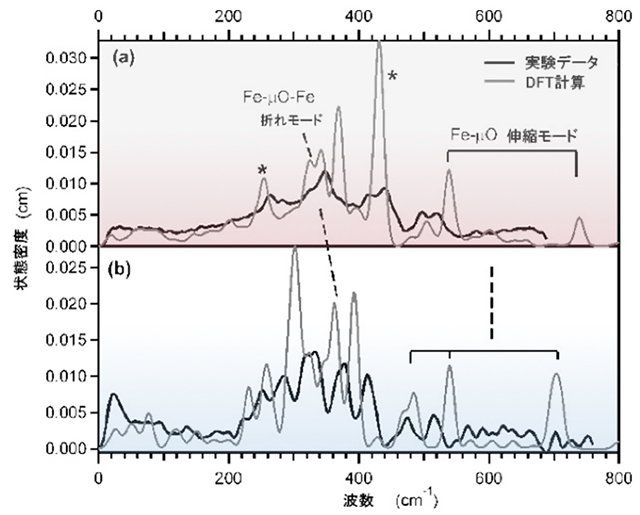
図2:低スピン錯体のNRVSスペクトルとDFT計算によるバンドの帰属
一酸素原子架橋した2核非ヘム鉄酵素錯体(上)と二酸素原子架橋した2核非ヘム鉄酵素錯体(下)
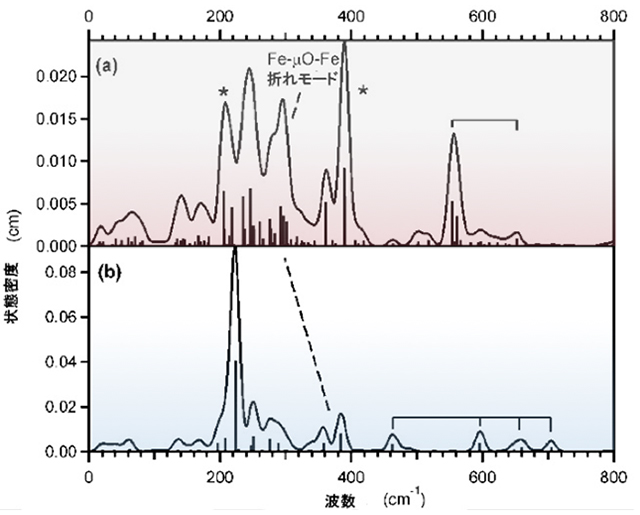
図3:高スピン錯体のNRVSスペクトルとDFT計算によるバンドの帰属
一酸素原子架橋した2核非ヘム鉄酵素錯体(上)と二酸素原子架橋した2核非ヘム鉄酵素錯体(下)
これらの解析により得られた二核非ヘム鉄モデル酵素錯体の分光学的知見は、リボヌクレオチドリダクターゼ (RNR)の高原子価中間体Xおよび可溶性メタンモノオキシゲナーゼの高原子価中間体Qの分子構造の解明に寄与することが期待されます。
今後の展開
今回の高原子価鉄-オキソ中間体のモデル錯体のNRVS分光解析を基本として、今後RNRの中間体XとsMMOの中間体Qの分子構造の解明に貢献することが期待されます。
RNRおよびsMMOはそれぞれDNA合成およびメタン酸化反応に関わる酵素であり、RNRの研究は細胞周期に関わるDNA合成に作用する抗がん剤の開発、sMMOの研究においてはバイオメタンからバイオメタノールの製造によるバイオ燃料の開発の基礎研究の進展に貢献することが期待されます。
本研究成果は、京都大学(瀬戸誠教授、斎藤真器名博士、小林康浩助教)、JASRIの依田芳卓主幹研究員、Stanford Univ.(Prof. E. I. Solomon, Dr. K. Park, Dr. C. B. Bell III, Dr. L. V. Liu, Ms. Y. Kwak, Mr. S. D. Wong, Mr. K. M. Light)、Univ. of Minnesota(Prof. L. Que Jr, Dr. D. Wang, G. Xue)、Advanced Photon Source(Dr. E. E. Alp, Dr. J. Zhao)および九州大学(太田雄大助教)の共同研究により得られたものです。
書誌情報
[DOI] http://dx.doi.org/10.1073/pnas.1304238110
論文名
Nuclear resonance vibrational spectroscopic and computational study of high-valent diiron complexes relevant to enzyme intermediates
著者
K. Park, C. B. Bell, L. V. Liu, D. Wang, G. Xue, Y. Kwak, S. D. Wong, K. M. Light, J. Zhao, E. E. Alp, Y. Yoda, M. Saito, Y. Kobayashi, T. Ohta, M. Seto, L. Que, and E. I. Solomon
ジャーナル名
Proceedings of the National Academy of Sciences of the United States of America (2013), published online on April/1/2013.

