2012年11月14日

左から新堂助教、高折教授、篠原研修員
このたび、 高折晃史 医学研究科教授、新堂啓祐 同特定病院助教、篠原正信 同研修員らは、細胞内に存在するシチジン脱アミノ化酵素APOBEC3蛋白が能動的にゲノムに変異を導入し、発癌に関わる可能性を報告しました。
本研究成果は、科学誌「Scientific Reports誌」に掲載されました。
概要
発癌は、ゲノム(宿主DNA)における遺伝子変異の蓄積の結果であり、従来よりその誘導因子として、紫外線、放射線、化学物質等の外来性因子が知られています(図1)。
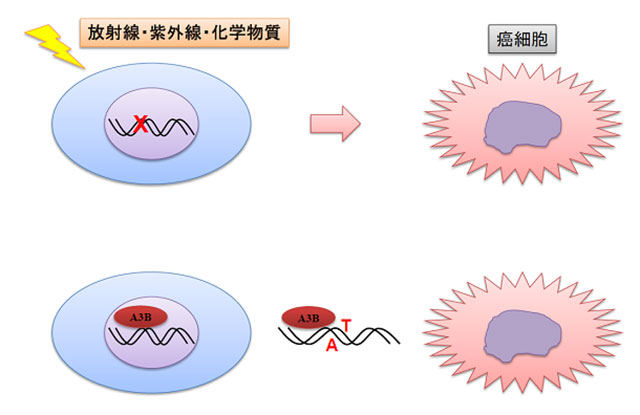
図1:APOBEC3Bによるゲノムへの変異導入と発癌
近年の次世代シークエンサーを用いたゲノムの網羅的解析により、様々な癌における、様々な遺伝子変異が報告されていますが、それらのなかで、多くの癌においては、C→T(相補鎖ではG→A)への変異が圧倒的に多数を占めています(図2)。また本年度、乳癌に関するゲノムの網羅的解析により、C→Tがゲノムの一部に偏って集積すること等から、APOBEC3蛋白が原因ではないかとの推測がなされていました(図3)。
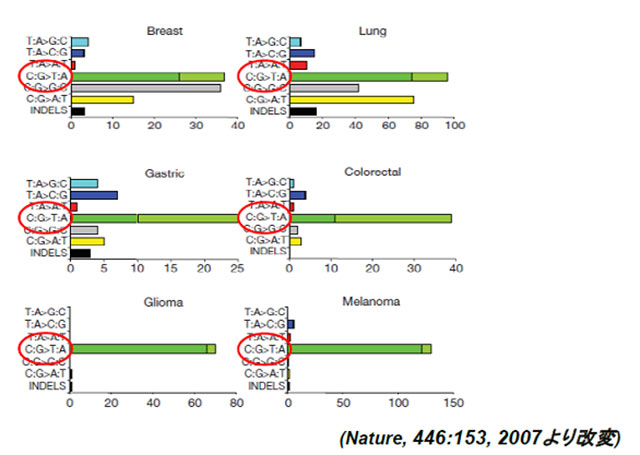
図2:各種癌における癌遺伝子への変異導入パターン
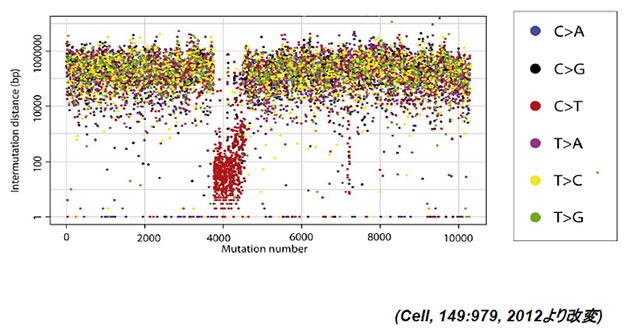
図3:乳癌患者にみられた集中的なC→T変異の例
本研究チームは、この偏りには何らかの原因があると考え、以下の理由からAPOBEC3蛋白が原因ではないかと考え研究を進めてきました。
APOBEC3蛋白は、細胞内の抗ウイルス因子として同定された分子群ですが、その本態は、DNAやRNAにCからTの変異を導入する遺伝子編集酵素です(図4)。そのプロトタイプであるAPOBEC3Gは、ヒト免疫不全ウイルス1型(HIV-1)が複製する際にできるウイルスの1本鎖DNAにC→Uへの変異を導入することで、最終的にウイルスゲノムに多数のG→Aへの変異を導入し、HIV-1の複製を阻害します(図5)。
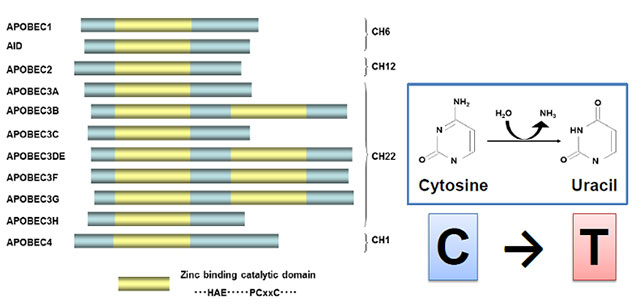
図4:シチジン脱アミノ化酵素:APOBEC3 ファミリー蛋白
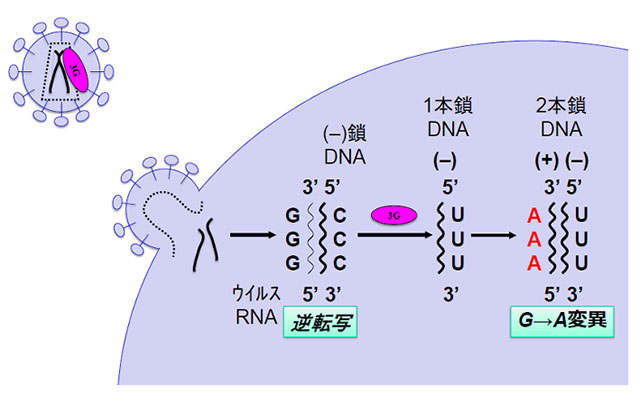
図5:APOBEC3Gによる抗HIV活性
その中で、AIDはB細胞のイムノグロブリン遺伝子(=抗体遺伝子)の多様性を生み出すのみならず、発癌への関与も示唆されています。しかしながらAIDはこれら多くの癌で発現が認められず、すべての癌の発癌を説明することは不可能です。
今回、本研究チームは、これらの酵素のなかで、APOBEC3BがヒトのゲノムにC→T(G→A)の変異を導入すること、血液悪性腫瘍のひとつである悪性リンパ腫で高発現しており、リンパ腫細胞において癌遺伝子にC→Tの変異を惹き起こしていることを突き止めました。
これは、細胞内に存在する酵素という内在性因子が、発癌遺伝子変異のソースであるという新たな発癌メカニズムと新規癌遺伝子の概念を提唱するものです。今後、乳癌等他の癌に関してもAPOBEC3B蛋白の発現が発癌に関わっている可能性を検証していきたいと考えます。またさらに、これらの研究を通じて、本分子の発現や酵素活性を調節することにより、新たな癌の制御法、特に予防や進行阻止につながる可能性があります。
書誌情報
[DOI] http://dx.doi.org/10.1038/srep00806
[KURENAIアクセスURL] http://hdl.handle.net/2433/161297
Shinohara Masanobu, Io Katsuhiro, Shindo Keisuke, Matsui Masashi, Sakamoto Takashi, Tada Kohei, Kobayashi Masayuki, Kadowaki Norimitsu, Takaori-Kondo Akifumi.
APOBEC3B can impair genomic stability by inducing base substitutions in genomic DNA in human cells.
Scientific Reports 2, Article number: 806. 2012/11/13/online.

