2012年10月5日

左から林准教授、斎藤教授
斎藤通紀 医学研究科教授と林克彦 同准教授らの研究グループは、マウスで多能性幹細胞であるES細胞とiPS細胞から卵子を作製し、それらの卵子から子供を産み出すことに成功しました。これまで同研究グループは、雄のES細胞やiPS細胞から精子を作製することには成功していましたが、雌のES細胞やiPS細胞から機能的な卵子を作製した成功例は世界でもなく、その技術開発が望まれていました。
研究グループは今回、雌のマウスのES細胞やiPS細胞を卵子や精子を作る元となる始原生殖細胞に試験管内で分化させて、それらをマウス胎仔の中から取り出した将来の卵巣になる体細胞と共に培養した後に、雌マウスの卵巣に移植することで未成熟卵子を得ました。それらの未成熟卵子を体外培養により受精可能な卵子にまで成熟させた後に、体外受精させることにより健常なマウスを得ました。これらのマウスは正常に成長し、子供を作る能力があることも分かりました。
この技術の開発により、卵子が形成されていくメカニズムの解明に貢献するものと期待されます。また、この技術を応用することで不妊症の原因究明などにも役立つものと期待されます。
本研究成果は、2012年10月4日(米国東部時間)に米国科学誌「Science」のオンライン速報版「Science express」で公開されました。
研究のポイント
- マウスのES細胞、iPS細胞から卵子を作製
- 作製された卵子から体外受精により健常なマウスを得ることに成功
- 卵子形成メカニズムの解明、不妊症の原因究明などに貢献
研究の背景と経緯
胚性幹細胞(ES細胞)や人工多能性幹細胞(iPS細胞)は、生殖細胞を含む体を構成するいずれの細胞にも分化することのできる細胞です。これらの細胞を任意の細胞に分化させる培養技術の開発は、再生医学領域の前進に大きく貢献するばかりでなく、体内では解析が不十分な発生や生理現象を体外培養により再現できることから、発生・細胞・幹細胞生物学分野においても非常に意義の深いものと考えられます。
卵子や精子を生み出す生殖細胞系列は、生体内の細胞系譜の中で唯一次世代に遺伝情報を伝達できる細胞系列であり、その発生異常は不妊や次世代の個体の疾患に深く関わることが知られています。すべての卵子や精子の起源となる細胞は始原生殖細胞と呼ばれ、個体の発生過程の比較的早い段階で分化します。始原生殖細胞はさまざまな発生過程を経て、雌では卵子に雄では精子に分化しますが、その発生過程の多くが胎仔期に行われていることもあり、解明されていない部分が多く残されています。
昨年までに、研究グループは雄のマウスのES細胞やiPS細胞から始原生殖細胞に類似した始原生殖細胞様細胞(Primordial Germ Cell-like Cells:PGCLCs)を試験管内で分化させて、それらを元に健常な精子と子孫を得ることに成功しました(Cell 2011)。これにより、体外で作製したPGCLCsは機能的な精子まで分化する能力があることが明らかとなりましたが、これらが卵子へ分化できる能力を持つかどうかについては不明でした。本研究グループでは、精子を作製する際に用いたPGCLCsの培養方法を応用して、マウスの雌のES細胞やiPS細胞から卵子を作製する培養技術を開発する研究を進めてきました。
研究の内容
本研究では、ES細胞やiPS細胞から試験管内で分化させたPGCLCsから機能的な卵子を作製することを目的として実験を行いました。正常な卵子は雌の始原生殖細胞から生じることが知られているために、まず本研究ではあらたに雌のES細胞を樹立しました。このES細胞は、始原生殖細胞に発現する遺伝子Blimp1と始原生殖細胞や卵子に発現する遺伝子Stellaが発現している場合に、蛍光たんぱく質が発現するように遺伝子(レポーター遺伝子)を改変したマウスから樹立しました。これにより、始原生殖細胞または卵子に分化した細胞は蛍光たんぱく質によって光を発するため、蛍光顕微鏡下で容易に観察できます。このレポーター遺伝子を持つ雌のES細胞から、精子を作製したときと同様の方法で、PGCLCsを分化させました。
これまでの研究により、ES細胞やiPS細胞から試験管内で分化させたPGCLCsは、培養1週間程度で発生を停止することが明らかになっていました。つまり、このままでは卵子まで分化させることは不可能です。そこで、本研究グループはマウス胎仔の中から将来の卵巣になる体細胞(雌生殖巣体細胞)を取り出し、ES細胞から分化させたPGCLCsと共に培養(凝集培養)しました(図1)。それにより、凝集された細胞塊中のES細胞由来のPGCLCsは増殖を開始しました。また、生体内の始原生殖細胞の発生過程に起こるX染色体の再活性化や刷り込み遺伝子の消去、減数分裂への移行がES細胞由来のPGCLCsで観察されました。これらのことから雌生殖巣体細胞の助けにより、PGCLCsは発生の停止を回避できることが明らかとなりました。
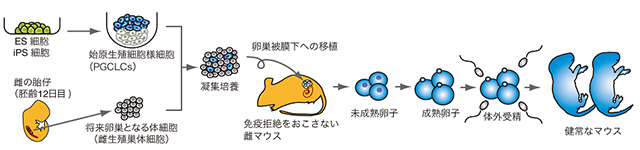
図1 ES/iPS細胞から卵子を作製するための実験手順
ES細胞から分化させたPGCLCsを将来卵巣となる体細胞(雌生殖巣体細胞)と凝集培養を行い、細胞の凝集塊を免疫拒絶のない雌マウスの卵巣被膜下に移植した。約4週間後の移植片から未成熟卵子を取り出し、体外培養により受精可能な成熟卵子まで分化させ、体外受精を行った。得られた受精卵を雌のマウスの卵管に移植することにより健常な個体を得ることに成功した。
次に、雌生殖巣体細胞とES細胞由来のPGCLCsの細胞凝集を、免疫拒絶反応を起こさない雌のマウスの卵巣被膜下に移植しました。その結果、約4週間後の移植片に未成熟な卵子が多数観察されました(図2)。移植片より採取したこれらの未成熟卵子は、Stellaの発現制御下にある蛍光たんぱく質を発現しており、ES細胞から分化させたPGCLCs由来であることが確認されました。さらに、これらの未成熟卵子を体外培養条件下で卵子を成熟させることにより、受精可能な成熟卵子を得ました。これらの成熟卵子を精子と体外受精させることにより得られた受精卵を仮親の雌マウスに移植した結果、健常なマウスが世界で初めて得られました(図2)。このマウスは正常に発達し、雌雄ともに生殖能力があると確認されました。

図2 ES細胞から分化させたPGCLCs由来の卵子とそれらの体外受精により得られた産仔
(上左)PGCLCsと雌生殖巣体細胞との凝集塊を移植してから約4週間後の移植片の写真を蛍光顕微鏡写真と合成したもの。移植片の中に蛍光を発する未成熟卵子がいることが観察される。(上中左)移植片から採取された未成熟卵子。(上中右)未成熟卵子の写真を蛍光顕微鏡写真と合成したもの。青色の蛍光たんぱく質を発現する様子が分かる。(上右)体外培養により成熟させた受精可能な成熟卵子。(下左)体外受精により得られた産仔。矢印で示した目の黒いものがES細胞由来のもの。(下右)得られた産仔は成長し、次世代のマウスを産んだ。
上記の研究に加え、雌の胎仔の繊維芽細胞から樹立したiPS細胞から卵子を作製する実験を行いました。実験に用いたiPS細胞はレポーター遺伝子を持たないことから、始原生殖細胞に発現する表面抗原SSEA1とIntegrin-β3を認識する抗体により、iPS細胞から分化させたPGCLCsを採取しました。それらを用いて、ES細胞を用いた場合と同様の凝集培養と雌マウスへの移植を行った結果、受精可能な成熟卵子の作製、健常マウスの取得に世界で初めて成功しました(図3)。
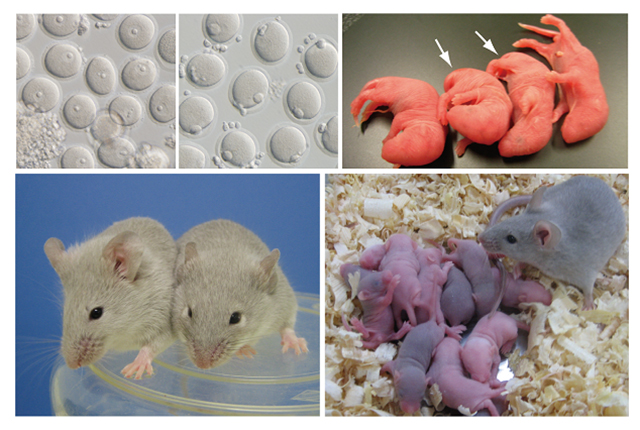
図3 iPS細胞から分化させたPGCLCs由来の卵子とそれらの体外受精により得られた産仔
(上左)iPS細胞から分化させたPGCLCsと雌生殖巣体細胞との凝集塊を移植してから約4週間後の移植片から採取された未成熟卵子。(上中)体外培養により成熟させた受精可能な成熟卵子。(上左)成熟卵子の体外受精により得られた産仔。矢印で示したものがiPS細胞由来のもの。(下左)得られた産仔は通常のマウスと同様に成長した。(下右)成長したiPS細胞由来のマウスは次世代のマウスを産んだ。
今後の展開
本成果は基礎および応用面の双方において大きな効果が期待できます。基礎面においては、始原生殖細胞の発生メカニズムの解明や卵子形成の初期段階の解析が可能になることです。生体内の始原生殖細胞は非常に少数であり、その増殖や分化のメカニズムや、卵子形成の初期段階である減数分裂への移行メカニズムなどに不明な点が数多く残されています。本研究による体外培養技術の開発によって、多数のPGCLCsを容易に作製でき、それらと雌生殖巣体細胞との相互作用を調べることが可能となりました。今後はこの体外培養技術を用いて、始原生殖細胞の増殖や分化のメカニズムや、減数分裂への移行メカニズムを明らかにできると考えられます。
また応用面においては、不妊症の原因究明に効果が期待できます。この体外培養技術では、ES/iPS細胞を起点として、始原生殖細胞から卵子形成の初期段階までの一連の分化過程を追えることから、この培養系を発生モデルとして用いて、始原生殖細胞の発生や卵子の分化・成熟に必要な遺伝子の単離に貢献すると考えられます。これらの遺伝子はヒトの不妊症の原因遺伝子となっている可能性があります。特に、iPS細胞からも卵子を作製できることから、不妊症患者さんからのiPS細胞を用いることにより、疾患原因遺伝子の同定を行うことが可能になると考えられます。しかしながら、本研究はマウスを用いた試験段階であり、マウスとヒトの相違点を考慮すると、応用面での貢献のためには、さらなる基礎研究が必要であると考えられます。また、卵子は生命の根源となる細胞ですので、倫理的な課題を慎重に検討する必要があると考えられます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 ERATO型研究
- 研究プロジェクト:「斎藤全能性エピゲノムプロジェクト」
- 研究総括:斎藤通紀(医学研究科 教授)
- 研究期間:平成23年度~平成28年度
戦略的創造研究推進事業 個人型研究(さきがけ)
- 研究領域:「エピジェネティクスの制御と生命機能」
(研究総括:向井常博(佐賀大学 名誉教授)) - 研究課題名:「始原生殖細胞の内因性リプログラミング機構による幹細胞制御」
- 研 究 者:林克彦(医学研究科 生体構造医学講座 機能微細形態学 准教授)
- 研究期間:平成23年10月~平成27年3月
論文名
[DOI] http://dx.doi.org/10.1126/science.1226889
"Offspring from Oocytes Derived from in vitro Primordial Germ Cell-like Cells in Mice"
(体外培養にて得られた始原生殖細胞に由来する卵子からのマウス産出に成功)
Hayashi Katsuhiko, Ogushi Sugako, Kurimoto Kazuki, Shimamoto So, Ohta Hiroshi, Saitou Mitinori.
- 朝日新聞(10月5日 1面・3面)、京都新聞(10月5日 1面・3面)、産経新聞(10月5日 1面・3面)、中日新聞(10月5日 1面)、日刊工業新聞(10月5日 22面)、日本経済新聞(10月5日 38面)、毎日新聞(10月5日 1面・2面)、読売新聞(10月5日 1面・2面)および科学新聞(10月26日 4面)に掲載されました。

