2012年9月14日


左から芹川 医学研究科附属動物実験施設長・教授、真下 特定准教授
真下知士(ましもともじ) 医学研究科附属動物実験施設特定准教授らの研究グループは、放射線生物研究センター、iPS細胞研究所、京大アステラス創薬プロジェクト(AKプロジェクト)、株式会社フェニックスバイオとの共同研究により、人工酵素ジンクフィンガーヌクレアーゼ(ZFN)を利用することで、世界で初めて重症免疫不全SCIDラットを作製することに成功しました。
免疫不全SCIDラットは、免疫学研究、移植研究、幹細胞研究などに広く利用されているSCIDマウスと比べて、より重度の免疫不全症を示しました。さらに、二つのZFNsを使うことで、SCID、XSCID両方の遺伝子を欠損するダブルノックアウトラット(FSGラット)を作製しました。このFSGラットは、T細胞、B細胞に加えて、ナチュラルキラー(NK)細胞も欠失した重症免疫不全症を示しました。これら重症免疫不全ラットに、ヒトiPS細胞、ヒトがん細胞、ヒト肝細胞を移植したところ、拒絶反応が認められず、ヒト細胞をラット体内で長期培養、増殖させることに成功しました。今回開発されたSCID、FSGラットは、がん研究、幹細胞研究、移植研究、創薬研究などに広く利用されるモデル動物になることが期待されます。
本研究成果は、9月13日付けの米国科学誌Cell Reports(Cell Pressオープンアクセス誌)オンライン版に掲載されました。
1.本研究成果のポイント
- 人工酵素ジンクフィンガーヌクレアーゼ(ZFN)を利用して、DNA依存性プロテインキナーゼ(Prkdc)遺伝子ノックアウトラット(SCIDラット)を作製しました。
- SCIDラットは、体重減少、細胞増殖率の低下、老化傾向などの特徴を示しました。また、機能的なT細胞およびB細胞を欠失する免疫不全症を示しました。SCIDマウスに見られる免疫グロブリンなどの「leaky(漏出)現象」は認められませんでした。
- さらに、SCID(Prkdc)、XSCID(Il2rg)両方の遺伝子を欠損するダブルノックアウトラット(FSGラット)を作製しました。FSGラットは、T細胞、B細胞に加えて、NK細胞を欠失していました。
- これら重症免疫不全ラットに、ヒトiPS細胞、ヒトがん細胞、ヒト肝細胞を移植することで、ラット体内でこれらヒト細胞を長期間培養、増殖させることに成功しました。
2.研究背景
SCIDマウスは、DNA.依存性プロテインキナーゼ(Prkdc)遺伝子の変異により、機能的T細胞およびB細胞を欠くことで、重度の免疫不全を呈します。そのため異種細胞・組織の移植に対する拒絶反応が少なく、ヒト正常細胞の異種移植が可能となり、腫瘍医学、免疫学、臓器移植などの分野で広く利用されています。また、SCIDマウスにはNK活性が残っていることから、それを取り除き細胞の生着率を向上させるために、I型糖尿病NODマウスと交配させたNOD-scidマウス、NOD-scidマウスとIL-2受容体ガンマ鎖(Il2rg)ノックアウトマウスを交配させた重症免疫不全のNOGマウスやNSGマウスなどが開発されています。
一方、実験用ラットは、ヒト疾患モデルとしての利用価値が高く、薬理薬効試験、毒性試験などに多用されています。近年、ジンクフィンガーヌクレアーゼ(ZFN)と呼ばれる人工ヌクレアーゼにより、これまで遺伝子改変技術がなかったラットにおいて、遺伝子改変を行うことが可能となりました。本研究では、ZFN技術を利用して重症免疫不全(SCID)ラットの開発を行いました。
3.本研究の成果(概要)
1) 免疫不全SCIDラットの作製
Prkdc遺伝子の第1エクソンを標的とするZFN(メッセンジャーRNA)をF344ラット受精卵の雄性前核に導入することで、Prkdc遺伝子を欠損したSCIDラットを作製することに成功しました(図1)。
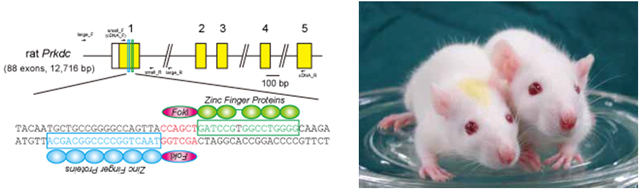
図1:(左)ラットPrkdc遺伝子の第1エクソンを標的として作製されたZFN。(右)Prkdc遺伝子を欠損したSCIDラット(左側)、対照動物F344ラット(右側)。
2) SCIDラットの特徴
SCIDラットは対照F344ラットと比べて、体重の減少、線維芽細胞(REF)の増殖能力低下、老化特性等を示しました。これまでSCIDマウスにはこのような特性は報告されておらず、マウスとラットの種差をあらわしていると考えられます。
さらに、SCIDラット由来のREF細胞は、放射線照射に対する高感受性を示し、放射線誘発二本鎖切断に対して、DNA修復能の低下を示しました。このDNA修復能の低下は、非相同末端結合(NHEJ)機構の欠損によるものと考えられました。
また、SCIDラットには胸腺の著しい委縮、T細胞、B細胞の欠落が認められました(図2)。SCIDマウスでは、一部の個体、あるいは加齢とともに血中IgGなどの免疫グロブリンが検出される「Leaky(漏出)」と呼ばれる現象が知られていますが、SCIDラットでは全ての個体においてLeaky現象が認められませんでした。
これらマウスとラット間におけるあきらかな特性の違いは、Prkdc遺伝子の生物種間における機能の差によるものと考えられました。
3) SCID、XSCIDダブルノックアウト(FSG)ラットの開発
さらに、Prkdc遺伝子を標的としたZFNと、Il2rg遺伝子標的としたZFNの二つのZFNsを使うことで、Prkdc遺伝子(SCID)とIl2rg遺伝子(XSCID)両方を同時に欠損したFSG(F344-scid Il2rg)ラットを作製することに成功しました。このFSGラットは、SCIDラットのさまざまな特性に加えて、胸腺、脾臓などの一次リンパ組織のさらなる萎縮や、T細胞、B細胞に加えてNK細胞の欠損が確認されました(図2)。
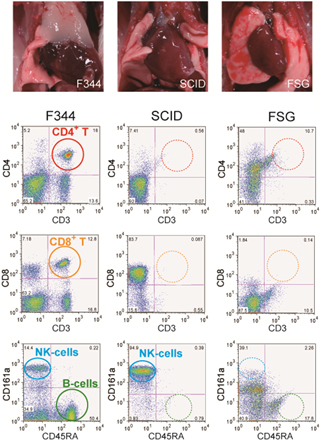
図2:SCIDおよびFSGラットにおける胸腺欠損(上)。SCIDラットではT細胞、B細胞が完全欠損しているが、FSGラットではさらにNK細胞も欠失している(下)。
4) ヒト細胞の異種移植
ヒト細胞移植モデルとしてSCID、FSGラットを評価するため、ヒトiPS細胞(201B7)をラットの精巣に移植しました。約6~8週間後に免疫不全ラットの全個体において、精巣内にテラトーマ(奇形腫)とよばれる内胚葉、中胚葉、外胚葉由来の多種類の分化した細胞を形成させることに成功しました(図3左)。
さらに、ヒト卵巣癌細胞株(A2780)をSCID、FSGラットの皮下に移植したところ、免疫不全ラットの全ての個体で、ヒト腫瘍細胞が増殖しました。FSGラットにおいて、SCIDラットよりもヒト卵巣癌細胞のはやい増殖が認められたことは、おそらくFSGラットのNK細胞欠失によるものと考えられます(図3中)。
最後に、このFSGラットを利用して肝ヒト化ラットの作製を試みました。肝細胞の増殖を阻害するアルカロイドの一種であるレトロルシンでFSGラットを処置した後に、門脈経由でヒト肝細胞を移植しました。移植後からすぐにヒトアルブミンがラット血中に持続的に検出されました。ヒト肝細胞移植6週後にFSGラットの肝臓を調べた結果、ヒト肝細胞の生着および増殖が確認されました(図3右)。
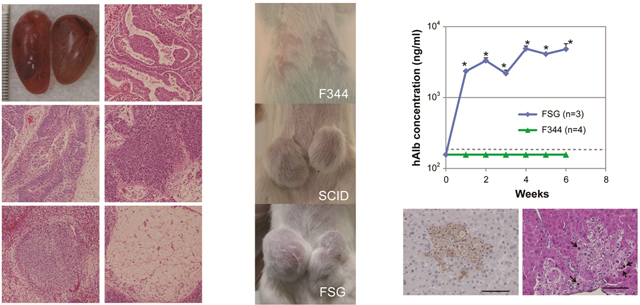
図3:(左)免疫不全ラット精巣内におけるヒトiPS細胞のテラトーマ形成。(中)SCID、FSGラット皮下移植によるヒト卵巣癌細胞の担がん試験。(右)肝ヒト化ラットの血中に検出されたヒトアルブミンと、ラット肝臓内に定着・増殖したヒト肝細胞。
4.今後の期待
今回、ZFN技術により新たに作製された免疫不全SCIDラット(Prkdcノックアウトラット)において、これまでSCIDマウスで報告されていた特性とは異なる点がいくつか発見されました。SCIDラットでは、体重減少、線維芽細胞の増殖能力低下、老化特性、leaky現象の欠落、より重度の免疫不全症などが確認され、これらの特性はヒトにより近いと考えられました。このことは、Prkdc遺伝子発現量の生物種間における「違い」により一部が説明され、放射線照射などによるDNA損傷に対する修復機構において、生物種による違いが存在すると考えられます。今後、ZFN技術等の遺伝子改変技術により、さまざまなノックアウトラットを作製して、マウス、ラット、ヒトの病態特性を比較することで、このような生物種による違いが明らかになっていくと考えています。
重症免疫不全SCIDラット、FSGラット(SCID、XSCIDダブルノックアウト)に、ヒトiPS細胞、ヒトがん細胞、ヒト肝細胞を移植することで、ラット体内でこれらヒト細胞を長期培養、増殖させることに成功しました。このように拒絶反応の弱い免疫不全動物にヒト細胞や組織を移植した動物のことをヒト化動物といいます。ヒト化動物は、動物体内においてヒト生理機能を調べる研究や、非臨床研究、創薬研究などにも利用することができます。これまではヒト化マウスを中心に研究が行われてきましたが、ラットはマウスに比べて体のサイズが約10倍あることから、血液や胆汁、細胞をたくさん採取することができます。また、生理学、薬理学、神経行動学、移植研究などに広く利用されている実験動物であり、ヒト化ラットは、ヒト化マウスに比べて様々なメリットがあると考えています。今後は、今回成功しなかったヒト血液幹細胞を移植したヒト化ラットなどの開発に取り組んでいきたいと考えています。
今回開発された重症免疫不全SCIDラット、FSGラットは、がん研究、幹細胞研究、移植研究、創薬研究などに幅広く利用されるモデル動物になることが期待されます。
5.掲載論文
雑誌名
Cell Reports(Cell Pressオープンアクセス誌)
http://cellreports.cell.com
[DOI] http://dx.doi.org/10.1016/j.celrep.2012.08.009
[KURENAIアクセスURL] http://hdl.handle.net/2433/159642
論文名
Generation and Characterization of Severe Combined Immune Deficiency Rats
「重症複合免疫不全ラットの作製と評価」
著者名
Tomoji Mashimo,1 Akiko Takizawa,1 Junya Kobayashi,2 Yayoi Kunihiro,1 Kazuto Yoshimi,1 Saeko Ishida,1 Koji Tanabe,3 Ami Yanagi,5 Asato Tachibana,5 Jun Hirose,4 Jun-ichiro Yomoda,4 Shiho Morimoto,1 Takashi Kuramoto,1 Birger Voigt,1 Takeshi Watanabe,4 Hiroshi Hiai,1 Chise Tateno,5,6 Kenshi Komatsu,2 and Tadao Serikawa1
真下 知士1、滝澤 明子1、小林 純也2、国広 弥生1、吉見 一人1、石田 紗恵子1、田邊 剛士3、柳 愛美5、立花 亜里5、廣瀬 潤4、四方田 純一郎4、森本 志保1、庫本 高志1、Voigt Birger1、渡邊 武4、日合 弘1、立野 知世5,6、小松 賢志2、芹川 忠夫1
著者所属機関名
1 Institute of Laboratory Animals, Graduate School of Medicine, Kyoto University
2 Genome Repair Dynamics, Radiation Biology Center, Kyoto University
3 Department of Reprogramming Science, Center for iPS Cell Research and Application, Kyoto University
4 Center for Innovation in Immunoregulative Technology and Therapeutics, Graduate School of Medicine, Kyoto University
5 PhoenixBio. Co. Ltd.
6 Liver Research Project Center, Hiroshima University
1 医学研究科附属動物実験施設
2 放射線生物研究センターゲノム動態研究部門
3 iPS細胞研究所初期化機構研究部門
4 医学研究科京大アステラス創薬プロジェクト(AKプロジェクト)
5 株式会社フェニックスバイオ
6 広島大学肝臓プロジェクト研究センター
本研究の一部は、以下の事業の助成を受けて実施されました。
- 厚生労働科学研究費補助金(創薬基盤推進事業)
「ヒト肝細胞キメララットによる新しい創薬評価モデルの開発」 - 独立行政法人新エネルギー・産業技術総合開発機構(NEDO)産業技術研究助成事業(若手研究グラント)
「標的遺伝子変異ラット作製のための新規システムの構築」 - SCIDラット、FSGラットは、文部科学省中核的拠点整備プログラム「ナショナルバイオリソースプロジェクト―ラット(NBRP-Rat)」に寄託されています。
- 朝日新聞(9月29日 15面)、京都新聞(9月14日 28面)、産経新聞(9月14日夕刊 10面)および日刊工業新聞(9月14日 20面)に掲載されました。

