
原田 グループリーダー・講師
2012年4月18日
原田浩 学際融合教育推進センター生命科学系キャリアパス形成ユニット 放射線腫瘍生物学グループリーダー・講師らの研究グループは、悪性がんの内部に局在する一部のがん細胞(腫瘍血管から100µm程度の距離に潜む低酸素がん細胞)が放射線治療を生き延び、HIF-1という遺伝子の働きによって腫瘍血管に向かって移動し、最終的にがんの再発を引き起こすというメカニズムを解明しました。また、HIF-1依存的な細胞の移動を抑制することで放射線治療後のがんの再発を防げることを見出しました。
この研究成果は、科学誌「Nature Communications」で発表されました。
1. 研究の背景
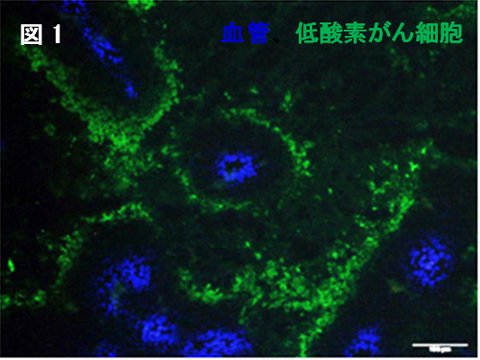
図1 腫瘍血管(青)から100µm程度の領域に低酸素がん細胞(緑)が存在する。有酸素がん細胞はその間に存在する。
厚生労働省が公表した資料によると、日本人の約2人に1人が生涯のうちにがんに罹患し、3人に1人ががんで命を落としていることが報告されています。外科手術、抗がん剤、放射線などの治療を施してもなお、満足な治療成績が得られない原因は、悪性がん内部の一部の細胞が治療を生き延び、がんの再発を引き起こすからであると考えられています。しかし、治療抵抗性がん細胞ががん組織内部の何処に巣食い、どのようにがんの再発を引き起こすのかは明らかにされておらず、がんの完治を妨げる障害となっています。
腫瘍血管を取り囲んで存在するがん細胞は、酸素と栄養源を容易に得ることが出来るため、活発に増殖しています。これらのがん細胞は有酸素がん細胞と呼ばれています(図1の青と緑に挟まれた領域に存在)。一方、血管から100µm程度離れているがん細胞は、血管から十分な酸素を得られないことから低酸素がん細胞と呼ばれています(図1 緑色の領域に存在)。多くの低酸素がん細胞は低酸素誘導因子1(hypoxia-inducible factor 1: HIF-1)という遺伝子の働きによって低酸素環境に適応していますが(以下、「HIF-1陽性低酸素がん細胞」といいます。)、HIF-1活性を得られないながらも辛うじて生きている低酸素がん細胞(HIF-1陰性低酸素がん細胞)も存在します。本研究で私達は「放射線治療後のがん再発における低酸素がん細胞の役割」を解析しました。
2. 研究成果
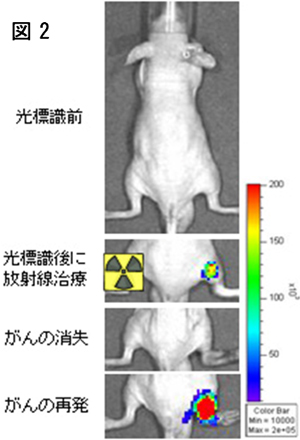
研究グループは、Cre-ERT2/loxP系を利用した部位特異的遺伝子組換え反応を利用して、HIF-1陽性低酸素がん細胞とHIF-1陰性低酸素がん細胞を光タンパク質で標識しました。そして、放射線治療後に再発してきたがんの内部に光標識細胞がどの程度存在するのかを定量しました。その結果、放射線治療前には悪性がんの17%にすぎなかったHIF-1陰性低酸素がん細胞が放射線治療を生き延び、再発がんの60%を占めるまでに増殖することを見出しました(図2)。この結果はHIF-1陰性低酸素がん細胞こそが再発がんの主な"源"であることを示しています。
次に、がんの再発過程でHIF-1陰性低酸素がん細胞がどの様に振舞うのかを解析しました。その結果、この細胞群が放射線治療後にHIF-1活性を獲得し、それを引き金に腫瘍血管に向かって移動し始めることが分かりました(図3)。またHIF-1阻害剤によってこの移動を抑制することで(図4)、放射線治療後のがんの再発を防げることを見出しました。
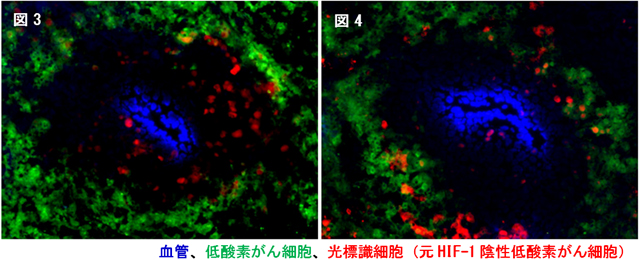
図3, 4 HIF-1陰性低酸素がん細胞(赤)は放射線照射後にHIF-1活性を獲得し、腫瘍血管(青)に向かって移動し始めた。この移動はHIF-1阻害剤によって抑制出来、これががんの再発抑制につながった。
3. 本研究の意義
放射線治療を生き延び、がんの再発を直接引き起こす細胞群を同定することに成功しました。また、がんの再発を導くメカニズムを明らかにすることが出来ました。これらの成果は、放射線治療後に活性化するHIF-1を阻害してがんの再発を防ぐという治療法の確立につながります。また、再発源となるがん細胞の局在が明らかになったことで、そこに高線量の放射線を集中照射するという放射線治療法の確立につながります。
4. 掲載論文
書誌情報
*Harada H, Inoue M, Itasaka S, Hirota K, Morinibu A, Shinomiya K, Zeng L, Ou G, Zhu Y, Yoshimura M, McKenna WG, Muschel RJ, Hiraoka M. Cancer cells that survive radiation therapy acquire HIF-1 activity and translocate towards tumour blood vessels. Nat. Commun. 3:783 doi: 10.1038/ncomms1786 (2012).
論文リンク
- 論文アクセスURL(DOI)
http://dx.doi.org/10.1038/ncomms1786 - KURENAIアクセスURL
http://hdl.handle.net/2433/155045
・本研究は以下の事業の助成を受けました。
最先端・次世代研究開発支援プログラム 「放射線治療抵抗性がん細胞の腫瘍内局在・動態の解明とイメージングプローブの開発(LS071)」
独立行政法人医薬基盤研究所 基礎研究推進事業 「化学放射線療法抵抗性の低酸素がん細胞を標的とする抗がん剤の開発 -抗がん剤のプロドラッグ化技術と分子イメージングによる薬効評価系を基盤に-(09-25)」
佐川がん研究助成振興財団 がん研究助成 「光イメージングによる幹細胞様がん細胞の移植腫瘍内動態解析とがん治療法確立への展開」
・本研究成果は以下の研究室の共同研究を通して得られました。
学際融合教育推進センター 生命科学系キャリアパス形成ユニット 放射線腫瘍生物学分野
医学研究科 放射線腫瘍学・画像応用治療学分野
大阪府立成人病センター研究所 生化学部門
医学研究科 麻酔科学分野
英国 オックスフォード大学 グレイ放射線腫瘍生物学研究所
関連リンク
学際融合教育推進センター 生命科学系キャリアパス形成ユニット 放射線腫瘍生物学(原田研究室)のホームページ
http://www.cp.kyoto-u.ac.jp/Harada/
- 朝日新聞(4月18日 37面)、京都新聞(4月18日 32面)、産経新聞(4月18日 28面)、中日新聞(4月18日 3面)、日刊工業新聞(4月18日 19面)、日本経済新聞(4月18日 46面)、毎日新聞(4月24日 13面)、読売新聞(4月24日夕刊 2面)および科学新聞(4月27日 6面)に掲載されました。

