2011年10月6日
岩田想 医学研究科教授と英国の放射光施設DIAMOND(オックスフォードシャー)のアレクサンダー・キャメロン博士らは、科学技術振興機構(JST)課題達成型基礎研究の一環として、高脂血症の治療薬の標的である「胆汁酸輸送体」の立体構造をX線結晶構造解析によって世界で初めて解明しました。
コレステロールは、ヒトの生体内で重要な役割を担っており必須な物質ですが、その血中濃度が過剰に高くなると高脂血症や動脈硬化症などを引き起こし、日本人の死因の2位および3位を占める心疾患や脳血管疾患を引き起こす要因になります。現在、主に用いられている高脂血症薬はコレステロールの合成を阻害するもので、肝障害などの副作用が起こることが知られており、異なる仕組みで働く薬の開発が望まれています。
血液中での過剰なコレステロールは肝臓で胆汁酸に変換され、脂肪の吸収を助けるために胆汁として消化器中に分泌されます。一部の胆汁酸は腸から排泄されますが、大半は小腸で吸収され、血液を通して肝臓に戻され再利用されています。胆汁酸の小腸での再吸収を行う膜たんぱく質が胆汁酸輸送体で、本研究グループは今回、バクテリア由来の胆汁酸輸送体の構造を胆汁酸の結合した形で解析し、胆汁酸が結合する結合領域を原子レベルで明らかにすることに成功しました。
胆汁酸輸送体と胆汁酸の結合を阻害すると、小腸から肝臓に循環する胆汁酸の量が減るために、コレステロールはさらに胆汁酸に変換され、血中のコレステロールの濃度が下がることが分かっています。このような阻害剤は血中に入らないため、副作用の少ない高脂血症薬として注目されています。今回解析したバクテリアの輸送体は、ヒトの輸送体とアミノ酸配列が似ていて胆汁酸の結合特性も似ていることから、得られた構造情報をもとに、腸内のほかのたんぱく質の働きに影響しないような新しい高脂血症薬として開発されることが期待されます。
本研究成果は、英国のインペリアルカレッジのデイビッド・デュリュー博士との共同研究で得られ、2011年10月5日(英国時間)に英国科学誌「Nature」のオンライン速報版で公開されました。
研究の背景と経緯
コレステロールは、血管などを形成する細胞膜に柔軟性を与えたり、各種ステロイドホルモン(男性ホルモン、女性ホルモンなど)の前駆体になるなど、生体内で重要な役割を担う化合物です。主に肝臓で合成され、血液によって体全体に輸送されます。また、肝臓でコレステロールから胆汁酸が生成され、脂肪の吸収を助けるために胆汁として消化器中に分泌されます。一部の胆汁酸は腸から排泄されますが、大半は小腸で吸収され、血液を通して肝臓に戻され再利用されています(図1)。このようにコレステロールは我々の体に必須な物質ですが、その血中濃度が過剰に高くなると、高脂血症や動脈硬化症などを引き起こし、心疾患や脳血管疾患を起こす要因になります。
胆汁酸輸送体は、胆汁酸の小腸および肝臓での再吸収を行う膜たんぱく質です。この時ナトリウムも同時に吸収されることが知られています。近年、胆汁酸輸送体の機能を阻害剤で抑えることにより、肝臓における胆汁酸の合成が促進され、これにより血中のコレステロールの濃度が低下することが分かっています。現在用いられている高脂血症の治療薬は非常に有効ですが、患者によっては肝障害などの副作用を引き起こすことが知られており、これらの代わりに、または併用される高脂血症薬として、胆汁酸輸送体の阻害剤が注目されています。
また胆汁酸輸送体は、胆汁酸に各種の薬物を付加した物質を高い効率で取り込めることが知られています。この性質を利用して、経口投与した時に体に取り込まれにくい薬物を、胆汁酸との複合体(プロドラッグ)として合成し、取り込みの効率を上げることが試みられています。
このような阻害剤やプロドラッグの効率の良い設計のために、胆汁酸輸送体の立体構造から胆汁酸の結合部分の詳細を明らかにすることが求められています。
一方で、胆汁酸輸送体は、細胞表面の膜中に存在する膜たんぱく質と言われる種類のたんぱく質です。膜たんぱく質は細胞内の可溶性たんぱく質とは異なり、不溶性の細胞膜中に存在しているため、安定した形で細胞膜から取り出すことが難しく、X線結晶構造解析は困難でした。本研究グループは、これまで困難であった膜たんぱく質の構造を明らかにするために、発現、精製、結晶化、X線構造解析技術を開発しています。これらの技術を組み合わせることにより、本研究では、バクテリア由来のナトリウム依存性胆汁酸輸送体(ASBT)(分子量:3万4千)の立体構造の解明を試みました。
研究の内容
本研究では、ヒトのASBTとアミノ酸配列が似ていて、かつ胆汁酸の結合特性も似ているバクテリアのASBTを解析しました。ASBTを精製し、結晶化を行い、X線結晶構造解析によって胆汁酸の一種であるタウロコール酸とASBTの複合体の立体構造を解明しました。
ASBTの全体構造は、膜を貫通した10本のらせん構造(へリックス)が二つのドメインに分かれており、一つは、6本の膜貫通のへリックスで構成されるコアドメインで、残りの4本の膜貫通のへリックスは、パネルドメイン(平らな板のような形をしているドメイン)を構成しています(図2)。ASBTの全体の立体構造は、アミノ酸配列が全く異なるナトリウムイオンの取り込みと水素イオンを放出する輸送体(ナトリウム/水素イオン交換輸送体)の構造と類似していることが分かりました。このことは、ASBTの構造は物質の輸送に用いられている普遍的な骨格であると考えられます。
ASBTの二つのドメインの間には、くぼみのような空間があり、胆汁酸の一種であるタウロコール酸が空間に結合していました(図3)。また、このタウロコール酸の結合部位の近くのコアドメイン内に、二つのナトリウムイオンが結合していることが分かりました。この部位のアミノ酸を遺伝子改変するとASBTの胆汁酸輸送能が失われることから、このナトリウムイオンの結合部位が重要な役割を担っていることが分かります。
さらに、タウロコール酸の結合部位はかなり余裕のある空間になっており、ASBTが非常に大きなプロドラッグを輸送できる可能性のあることを示しています。タウロコール酸が直接接触しているたんぱく質部位を改変すると、タウロコール酸の輸送能が急激に減少しました。これは、この部分に強く結合するような物質が、胆汁酸輸送体に対しての有効な阻害剤となり得ると考えられます。
これらの構造の情報と生化学的な知見から、胆汁酸輸送体の輸送の仕組みを推定することが可能になりました。ASBTにナトリウムイオンが細胞の外から結合すると、コアドメインの構造を変え、比較的大きな化合物である胆汁酸を結合しやすくします(図4A)。そして胆汁酸が二つのドメインの間の空間に結合すると、もう一つのパネルドメインが動いて、胆汁酸とナトリウムを同時に細胞内へ放出を促すことが分かりました(図4B)。このような仕組みにより、胆汁酸のような水に溶けにくくて大きな化合物を細胞内へ効率よく運んでいることが分かりました。
今後の展開
本研究結果からASBTの立体構造が明らかになり、ナトリウムイオンと胆汁酸の結合部位の詳細な情報を得ることができました。これらの立体構造の情報をもとに、今後、新しい胆汁酸輸送体の阻害剤の探索・設計が可能になると考えられ、高脂血症や動脈硬化症の治療薬への貢献が期待されます。また胆汁酸の結合様式、および結合するキャビティーの大きさが明らかになったことにより、胆汁酸のどの部分にどのようなサイズの薬物を付加すれば効率の良いプロドラッグを合成できるかという指針を示すことができました。
さらに本研究の結果から、ナトリウムイオンを用いて胆汁酸を輸送する分子メカニズムも明らかになりました。ナトリウム/水素イオン交換輸送体を含むほかの多くの輸送体でも同様な構造の変化によって輸送体が機能していると考えられ、各種輸送体の機能の異変により生ずる病変や生化学的現象を理解するための基礎情報になると考えられます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
- 研究プロジェクト:「岩田ヒト膜受容体構造プロジェクト」
- 研究総括:岩田想 医学研究科教授
- 研究期間:平成17~23年度
JSTはこのプロジェクトで、構造解析の極めて困難な疎水的な膜たんぱく質であるヒト膜受容体の構造解析において、膜受容体の精製・結晶化の普遍的な技術を確立し、ヒト膜受容体構造解析を系統的に行う技術の確立を目指しています。
参考図
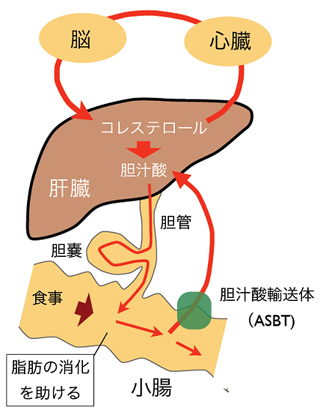
- 図1 コレステロールの肝腸循環
コレステロールは主に肝臓で合成され、血液によって体内を循環する。血液中で過剰なコレステロールは肝臓で胆汁酸に変換され、胆汁として消化器系での脂肪の吸収を助ける。胆汁酸の大半は、胆汁酸輸送体により肝臓に戻り再利用される。
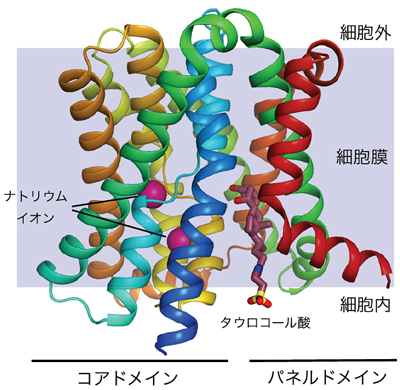
- 図2 ASBTの立体構造(全体)
ASBTの立体構造は、10本の膜貫通したらせん構造(へリックス)が二つのドメインに分かれている。一つは、6本の膜貫通のへリックスで構成されるコアドメイン(左)で、残りの4本の膜貫通のへリックスはパネルドメイン(右)を構成している。コアドメインには胆汁酸輸送体の活性に必要なナトリウムイオンが二つ配置されている。
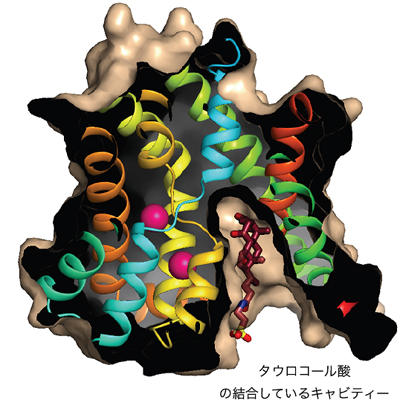
- 図3 ASBTでタウロコール酸が結合している部位
ASBTの二つのドメインの間には、くぼみのような空間(キャビティー)があり、胆汁酸の一種であるタウロコール酸がキャビティーに結合している。このキャビティーは、タウロコール酸が結合してもかなり余裕のある空間になっていることから、比較的大きな化合物が輸送できると考えられる。
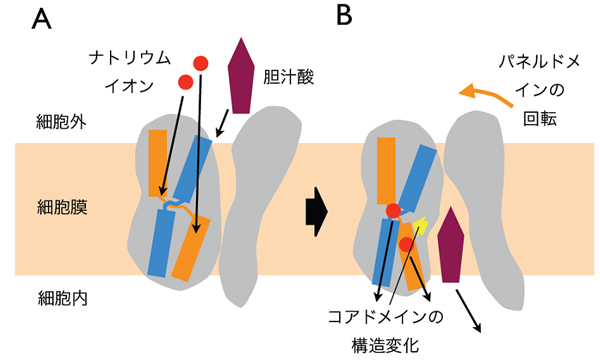
- 図4 ASBTの構造変化による輸送のメカニズム
ASBTの立体構造の情報などをもとに、胆汁酸輸送体の輸送が、(A)ナトリウムイオンが細胞の外から結合することでコアドメインの構造を変化させ、胆汁酸を結合しやすくし、(B)胆汁酸が二つのドメインの間のキャビティーに結合すると、もう一つのパネルドメインが動いて、胆汁酸とナトリウムを同時に細胞内へ放出を促すことが分かった。
論文名
“Crystal structure of a bacterial homologue of the bile acid sodium symporter ASBT”
(ヒトの胆汁酸輸送体と類似のバクテリア胆汁酸輸送体の立体構造解析)
Nien-Jen Hu, So Iwata, Alexander D. Cameron, David Drew
関連リンク
- 論文は以下に掲載されております。
http://dx.doi.org/10.1038/nature10450 - 以下は論文の書誌情報です。
Hu NJ, Iwata S, Cameron AD, Drew D. Crystal structure of a bacterial homologue of the bile acid sodium symporter ASBT. Nature (2011) Published online 05 Oct. doi:10.1038/nature10450
- 京都新聞(10月6日 23面)および科学新聞(10月14日 6面)に掲載されました。

