2011年5月25日

左から岡村教授、土居雅夫 薬学研究科
准教授
岡村均 薬学研究科教授らの研究グループの研究成果が「Nature Communications」誌に掲載されました。
研究の概要
私たちが毎朝朝寝坊することなく決まった時間に起きることができるのは、脳の中の視交叉上核(英名Suprachiasmatic nucleus, 略してSCN)とよばれる神経核において約1万のニューロン群が毎日きわめて安定で強力な24時間周期のリズムを生み出しているからです。驚くべきことに、SCNは脳から取り出し生体外で培養しても、正確なリズムを1年以上にわたって打ち続けることができるのです(映像1)。
| 映像1: SCNニューロン群の細胞リズム動態 正常およびRGS16欠損マウスにおけるPer1-luc SCNスライス発光ムービー(上)とそれぞれのSCNにおける背側部(黄色)、中央部(赤)、および腹側部(青)における個々のニューロンの発光リズム(下) |
ではなぜSCNのリズムはこれほど強力で安定なのでしょうか?本研究グループは今回その秘密に迫りました。実は、リズムを生み出すだけならSCN以外のその他の全身の末梢組織の細胞にも能力は備わっています。しかし、末梢組織の個々の細胞のリズムはすぐに乖離してしまうので全体としてリズムは長続きせず減衰してしまいます(個々のリズムが無秩序でバラバラでは全体として有効なリズムは生まれません)。これに対し、SCNのニューロン群は強固なニューロンネットワークを形成し、整然とした時間順序で、強固に同期することによって、組織としてより大きく安定なサーカディアンリズムを生みだしているのです。本研究グループはこのSCNニューロンの重要な特性を発見し2003年に報告しましたが(Science 302, 1408-12, 2003)、今回はその特性を生み出すための分子メカニズムに迫りました。
SCNの細胞間の同期の様子は、Per1-lucトランスジェニックマウスのSCNスライス培養系を用いたリアルタイムイメージングによって、個々の細胞におけるPer1遺伝子(時計の振り子の役目を担う最も重要な時計遺伝子)の発現を追跡することで詳しく調べることができます(映像1)。興味深いことに、SCNのニューロン群はどれも一様というわけではなく、リズム発振の先導部とされる背内側部の細胞群とそれに追随する腹側部の細胞群に大きく分けられます。すなわち、正常のマウスのSCNにおいては、Per1の発現は背内側部の細胞から始まり腹側部へと向かって波のように広がっており、この独特の時空間パターンにしたがって細胞が同期しているのです。
しかしながら、なぜいつも背内側部の細胞が早いのか、細胞間の同期や順位づけの機能はSCNにとって最も重要な性質であるのにもかかわらず、その仕組みや生理的な意義についてはこれまで全くわかっておりませんでした。
今回注目したのは、SCNの背内側部の細胞において早朝Per1の発現とともに同時に出現するRGS16(Regulator of G-protein Signaling 16)とよばれるG 蛋白質シグナル制御因子です(図1)。非常に興味深いことに、遺伝子組み換えを行って作り出したRGS16欠損マウスのSCNにおいては、ふだんなら先頭集団を形成するはずの背内側部の細胞群のリズムが遅れ(映像1)、その結果、マウスは朝寝坊となってしまうことがわかりました。
SCNにおけるRGS16の機能を生化学・組織化学・薬理学的手法を駆使して詳細に調べた結果、我々は、RGS16が細胞内のGαi蛋白質と結合し、その活性を抑えることでcAMPシグナルを促進させていることを突き止めました(図1)。背内側部においては、早朝にRGS16が現れると、それに続いてcAMPシグナルが流れはじめるため、Per1の発現がどこよりも早く惹起されていたのです。一方で、早朝以外の時間では反対にRGS16の発現が低下するので、抑制を逃れたGαi蛋白質が今度は細胞内のcAMPシグナルを止めてしまいます。早朝以外の時間帯はたとえ細胞外から刺激があってもそのシグナルは遮断されるてしまうのです。つまり、RGS16は朝のみ現れてGαiを抑制することによってcAMPシグナルを解除し、その他の時間帯では遮断をするという、いわば細胞間連絡にかかわるシグナルの「仕わけ」を行っており、その機構によって背内側部に特有の早いリズムが生み出されていることがわかったのです。
以上の結果は、これまで謎に包まれていたSCN時計の秘密に迫るものです。我々は、RGS16の研究を通じて、細胞「内」の時のシグナルの仕分けが、細胞「間」の同期のパターンを決め、ひいてはそれによって個体レベルの活動リズムの周期までが決められていることを示しました。この成果は、「如何にして脳の神経ネットワークが個体の行動パターンを規定するのか?」という脳の仕組みの核心へ迫る非常に重要な所見を提供するものだと考えています。
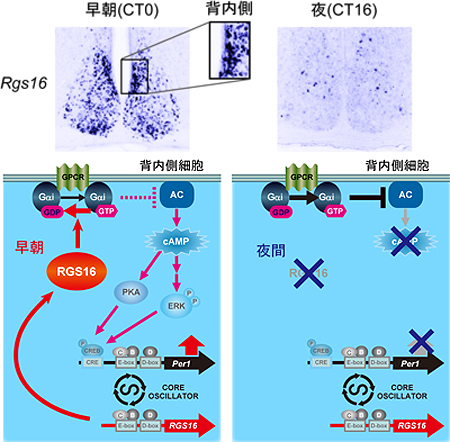 | 図1: 早朝でのSCNの背内側部におけるRGS16陽性細胞の出現(Dig-in situ hybridization)とこの細胞におけるRGS16を介した細胞内シグナル伝達のモデル 図中の略語: C, CLOCK; B, BMAL1; D, DBP; CRE, cAMP responsive element; AC, adenylate cyclase; PKA, cAMP-dependent protein kinase; ERK, extracellular signal-regulated kinase; CREB, CRE-binding protein; P, phosphate. |
関連リンク
- 論文は以下に掲載されております。
http://dx.doi.org/10.1038/ncomms1316
http://hdl.handle.net/2433/141786 (京都大学学術情報リポジトリ(KURENAI)) - 以下は論文の書誌情報です。
Doi M, Ishida A, Miyake A, Sato M, Komatsu R, Yamazaki F, Kimura I, Tsuchiya S, Kori H, Seo K, Yamaguchi Y, Matsuo M, Fustin JM, Tanaka R, Santo Y, Yamada H, Takahashi Y, Araki M, Nakao K, Aizawa S, Kobayashi M, Obrietan K, Tsujimoto G, Okamura H. Circadian regulation of intracellular G-protein signalling mediates intercellular synchrony and rhythmicity in the suprachiasmatic nucleus.
Nature Communications 2 : 327 doi:10.1038/ncomms1316 (2011)
- 朝日新聞(6月2日 27面)、京都新聞(5月25日 23面)、産経新聞(5月25日 24面)、日刊工業新聞(5月25日 25面)、日本経済新聞(5月25日夕刊 14面)および読売新聞(5月25日 33面)に掲載されました。


