2011年5月12日
森博幸 ウイルス研究所准教授と濡木理 東京大学大学院理学系研究科教授、塚崎智也 同助教、伊藤維昭 京都産業大学総合生命科学部教授らの研究グループは、細胞内でリボソームにより合成された蛋白質が生体膜を超えて輸送される際に、重要な役割を果たす膜蛋白質SecDFの詳細構造を世界で初めて解明しました。その構造から「生体膜を隔てた陽イオンの濃度差を利用してSecDFが大きな構造変化を繰り返し、膜を超えた蛋白質輸送に関与する」という新たな仮説を提唱し、いくつかの生化学と生物物理学の手法を駆使してこの仮説を立証しました。生命体に欠くことのできない基本的な生命現象の一つである蛋白質の輸送の仕組みを原子レベルで解析した本研究成果は、当該分野のみならず膜を超えた細胞内外へのイオンや薬剤等の輸送の研究にも大きな影響を与えることが期待されます。
本研究成果は、英国科学誌ネイチャー電子版に5月12日2時(日本時間)付けで公開されました。
(論文)
“Structure and function of a membrane component SecDF that enhances protein export”(蛋白質の膜透過を促進する膜蛋白質SecDFの構造と機能)
塚崎智也*、森博幸*、越前友香、石谷隆一郎、深井周也、田中剛史、Perederina Anna、Vassylyev Dmitry G.、河野俊之、Maturana Andre's D.、 伊藤維昭**、濡木理**(*同等貢献、**責任著者)
研究の背景
すべての細胞には新しく合成された蛋白質が、合成の場である細胞質からその蛋白質が実際に働く場所へと生体膜を超えて分泌輸送される仕組みが備わっています。通常はイオンすら通さない生体膜が蛋白質という巨大な分子を透過させることができるのは、生体膜に蛋白質を膜透過させるための専用のチャネル(Secトランスロコン)が存在しているからです。蛋白質の輸送の仕組みについては、後にノーベル賞の受賞に結びついた、1975年にブローベルらが発表した「シグナル仮説」をはじめ、現在に至るまで数多くの研究結果が発表されています。原核生物におけるSecトランスロコンはSecYEGと呼ばれる膜蛋白質の複合体であり、Secトランスロコンを介した蛋白質の分泌は膜に局在するモーター蛋白質SecA によって駆動されています(図1A)。この時ATPがエネルギーとして使われますが、蛋白質の分泌がプロトン駆動力(PMF)によっても促進されることは謎でした。
研究成果と意義
本研究では、真正細菌や古細菌で蛋白質の分泌に関わることが知られていたSecDFという膜蛋白質に着目しました。SecDFはSecYEGと複合体を形成し蛋白質の膜透過を高効率化していると考えられていましたが、実際にどのような働きをしているのかはほとんどわかっていませんでした。その原因としてSecDFが水に溶けにくい膜蛋白質であり取扱が困難であったことや、SecDFの働きを細胞の形が失われた試験管内反応で解析することが困難であったこと等があげられます。今回の発表は、本研究グループの7年間にわたるSecDF研究が実を結んだものです。まずSecDFを安定かつ大量に精製する方法を確立し、結晶化に成功しました。続いて、大型放射光施設SPring-8を利用したX線結晶構造解析によってSecDFの構造を高分解能で決定しました。さらに、得られた立体構造から予測されるSecDFの機能部位を改変する一連の解析からSecDFの働きを初めて明らかにしました。
SecDFの結晶構造から、SecDFは疑似2回対象に配置した12本のα-ヘリックスからなる膜貫通領域と2つの細胞外(ペリプラズム)領域(以下P1, P4と略します)から構成されることがわかりました(図1B)。P1領域は2つの構造単位、ヘッド領域とベース領域からなります。SecDFのP1領域はダイナミックな構造変化を起こし、ヘッド領域の配向が異なったF型とI型の2つの形をとります(図2)。また、SecDFの膜貫通領域はPMFを利用した薬剤排出トランスポーターAcrBの膜貫通領域と類似の構造をとることがわかり、SecDFも水素イオンを利用することが考えられました。in vitroにおける蛋白質の膜透過反応を調べることによって、ATPとSecA が必要とされる膜透過を開始するステップと、その後ATPがなくても進行する蛋白質膜透過の後期・完了ステップに分けて解析することができます。この実験によりSecDFとPMFはこのATPに依存しない後期ステップに必要であることが突きとめられました。海洋性細菌由来のSecDFは、水素イオンの代わりにナトリウムイオンを利用して蛋白質膜透過を促進していることも明らかとされました。パッチクランプ法による電気生理学的解析とSecDFの変異体解析によって、SecDFの膜貫通領域にはプロトンの通り道が存在することがわかり、この膜貫通領域の中心部に存在する進化的に保存されたアスパラギン酸残基、アルギニン残基(図3)が、プロトンの透過とSecDFの働きの両方に必須であることが証明されました。一方、膜から突出したP1領域は、膜透過途上にある分泌蛋白質など安定な構造をとっていない蛋白質と結合する性質があることがわかりました。P1領域の変異体解析から図2に示したP1領域の構造変化が実際に生体内で起こり、この構造変化が蛋白質の膜透過反応に重要であることを示しました。以上の結果から、図4に示したように「SecDFは水素(陽)イオンの細胞内への流入を利用して大きな構造変化を繰り返しながら、ペリプラズム側で膜透過基質蛋白質と相互作用し、膜透過の高効率化に寄与する膜内在性シャペロンである」との結論を得ました。
本研究では、蛋白質の膜透過に関わるSec蛋白質群のなかで唯一構造の報告がされていなかったSecDFの構造を明らかとし、その機能の詳細を解明しました。今後、本研究成果によって図1に示したSecトランスロコン複合体の立体構造と機能解析の研究が大きく進展することが期待されます。そして、膜を隔てた物質輸送の研究分野一般にも大きな影響を与えることが期待されます。また近年多剤耐性遺伝子を持つ病原菌が問題となっていますが、これらの菌体はSecDFを持つため、SecDFの細胞外領域を標的とする新しいタイプの抗生物質が発見につながるなど、基礎科学だけでなく医学への応用も期待されます。
本研究成果は、文部科学省科学研究費補助金[特定領域研究(22020008, 22020035),新学術領域研究(22121503)],日本学術振興会科学研究費補助金[基盤(S)(20227003), 基盤(A)(20247020), 基盤(B)(22370070), 若手研究B(21770135)], ターゲットタンパク研究プログラム, 科学技術振興機構バイオインフォマティクス推進センター (BIRD)などの支援を受けました。
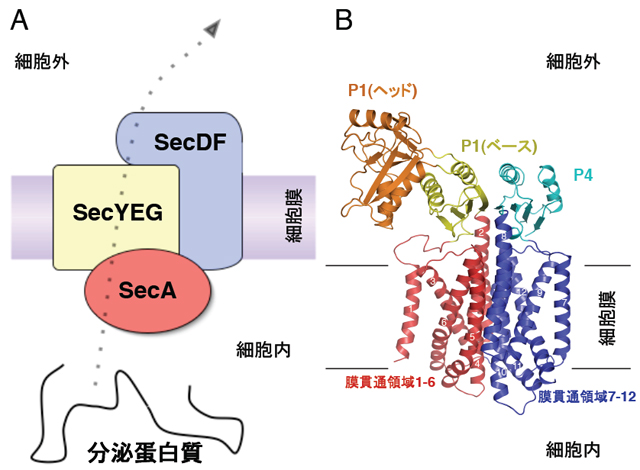
- 図1 蛋白質の膜透過とSecDFの詳細構造。
A、 Sec蛋白質複合体による蛋白質の膜透過の模式図。
B、 SecDFの結晶構造。数字で示した12回の膜貫通領域(1-6と7-12が疑似2回対象)と細胞外(ペリプラズム側)に突出した領域から構成されています。
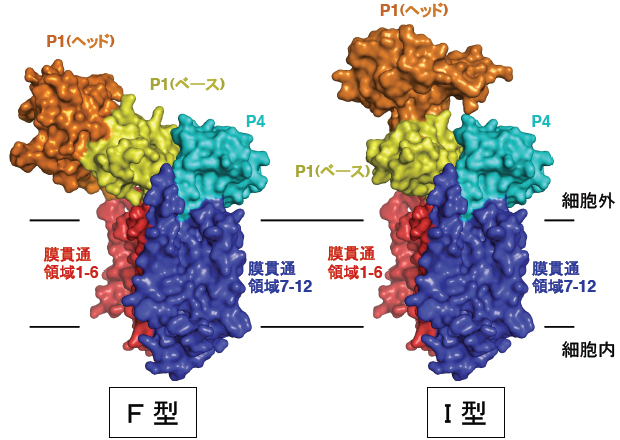
- 図2 SecDFのF型とI型。P1領域のヘッド領域の配向が異なった2つの形をとります。
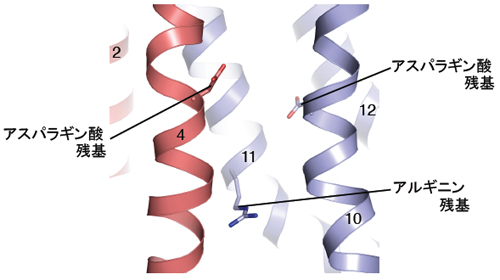
- 図3 SecDFの機能に重要なアミノ酸残基。膜貫通領域の中心部の膜貫通領域の拡大図を示しました。数字は膜貫通領域の番号を表しています。
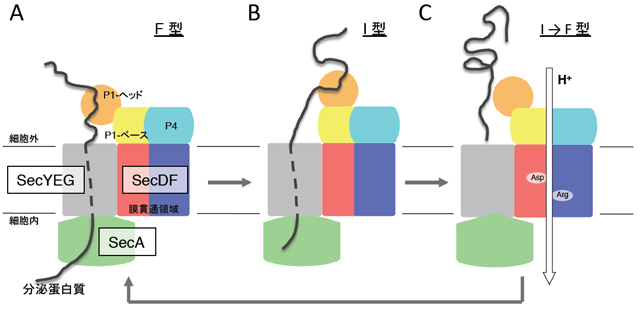
- 図4 PMFを利用したSecDFの機能モデル。SecDFはSecYEGと複合体を形成します。SecA ATPaseによってSecYEGを介して運搬された前駆体蛋白質は細胞外でSecDFの細胞外領域と相互作用します(A)。その後SecDFはF型からI型へと前駆体蛋白質を保持したまま構造変化を起こし、蛋白質を透過させます(B)。最終的にプロトンの透過により、SecDFは蛋白質を手放し、I型からF型へと構造変化をします(C)。このような過程を繰り返すことによりSecDFは蛋白質の膜透過に関与するとのモデルを提唱しました。※ 必須のアルギニン残基(Arg)、 アスパラギン酸残基(Asp)を図中に模式的に示しています。
関連リンク
- 論文は以下に掲載されております。
http://dx.doi.org/10.1038/nature09980 - 以下は論文の書誌情報です。
Tomoya Tsukazaki, Hiroyuki Mori, Yuka Echizen, Ryuichiro Ishitani, Shuya Fukai, Takeshi Tanaka, Anna Perederina, Dmitry G. Vassylyev, Toshiyuki Kohno, Andres D. Maturana, Koreaki Ito & Osamu Nureki Structure and function of a membrane component SecDF that enhances protein export.
Nature Published online 11 May 2011

