2011年1月19日

左から井上教授、齊藤准教授、藤田祥彦 生命科学研究科助教、
樫田俊一 生命科学研究科大学院生
井上丹 生命科学研究科教授、齊藤博英 次世代研究者育成センター(白眉プロジェクト)准教授らの研究グループは、特定のたんぱく質を発現したターゲット細胞の生死を制御することができる「RNAスイッチシステム」の開発に成功しました。
がんや神経病などのさまざまな疾患には、細胞内での病原たんぱく質の増加や正常なたんぱく質の合成不良などが原因となっているものが多くあることが分かり、このような特定のたんぱく質を標的とした薬の開発や治療の研究が世界中で進められています。一方で、このようにして開発された薬や近年精力的に進められている研究においては、体内に投与した際に副作用が起こることが避けられないのが現状です。その理由は、異常細胞のみならず、正常な細胞にも薬が効いてしまうことで、正常な機能に悪影響を与えるからと考えられています。このため、特定の細胞だけに薬を効かせる技術や、悪性のがん細胞だけに細胞自殺(アポトーシス)を誘導する技術の開発が求められていました。
本研究グループは発想を転換して、細胞の中でその細胞が悪性かどうかを判断し、薬を効かせることで上記の問題を克服できると考え、悪性細胞の印となりうる特定のたんぱく質を発現している細胞でのみ働くようにする「RNAスイッチシステム」を開発しました。
これまでに本研究グループは、特定のたんぱく質の発現に応答して、mRNAから目的たんぱく質の翻訳を抑制する「オフスイッチ」の開発に成功していました。今回、RNA干渉(RNAi)を制御する技術を基盤として、たんぱく質合成を活性化する「オンスイッチ」を新しく開発しました。また、2つのRNAスイッチを活用して、細胞内のアポトーシス調節たんぱく質の発現を制御することに取り組みました。その結果、特定のたんぱく質を発現している細胞のみを死に至らしめられる、高度な細胞生死のコントロール技術の創出にも成功しました。さらに、この2つのRNAスイッチは細胞内で独立に作動することが確認され、同じ特定たんぱく質の発現に応答して、異なる2つのたんぱく質の抑制・活性化を同時に制御できることも分かりました。
この成果は、ヒトの細胞内で、入力たんぱく質Aの情報(発現)を出力たんぱく質Bの情報(抑制・活性化)に直接変換できる「人工情報変換システム」を構築した世界で初めての例です。今後、多種のRNAスイッチを同時に適用することで幅広い細胞制御が可能となり、対応できる疾患の幅も大きく広がることが期待されます。このような生命システムを制御する技術の開発は、シンセティックバイオロジー(合成生物学)や次世代バイオテクノロジーの新技術としても期待されます。
本研究で開発されたRNAスイッチシステムは汎用性が高く、RNA配列を改変するという簡便な操作だけで、研究や医療で用いられている人工mRNAやRNAiの手法全般に応用が可能な技術であり、画期的な技術と言えます。従来の薬の概念を変える副作用のない夢の医薬や、再生医療をはじめとするさまざまな次世代分野において、新しい研究手法・治療法として役立つことが期待されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 国際共同研究事業(ICORP)「RNAシンセティックバイオロジープロジェクト」(代表研究者:井上 丹)の一環として行われ、本研究成果は2011年1月18日(英国時間)に英国オンライン版科学雑誌「Nature Communications」で公開されます。
<論文名>
“Synthetic human cell fate regulation by protein-driven RNA switches”
(たんぱく質に応答するRNAスイッチを用いた人工細胞運命制御システムの構築」
研究背景
ヒトの細胞一つひとつには、全身を作る設計図である遺伝子全て(DNAゲノム)が内蔵されています。一方で、ヒトの体は筋肉や神経、血液など約200種類のばらばらな特徴を持った細胞から成り立っており、各細胞はDNAゲノムのうちの特定の部分を読み出して(mRNAに転写)、特定のたんぱく質を合成(mRNAの情報を翻訳)することで各々の特徴を持つことができます。そして、この特徴が異常になるとがんなどの疾患を引き起こすため、疾患の治療薬として特定の病原たんぱく質の働きを抑える薬が開発されつつあり、また簡便かつ強力に細胞内の特定たんぱく質の合成を制御する医薬開発が進められています。
一方、従来の治療薬では悪性細胞への特異性が低いため、正常な細胞にまで影響を及ぼしてしまうなどの、副作用が強いことが常に問題となります。例えば、がん細胞の増殖を抑える薬効はがん細胞以外の正常細胞の増殖までをも抑えてしまうため、全身の細胞増殖を遅らせてしまい、重い副作用が知られています。また、がん細胞を殺すほどの強い薬を作成したとしても、特異性が低いゆえに正常細胞をも殺してしまうことになるので、そのような強力な薬は使用できません。現状の創薬開発においても、特異性の低さが問題となっており、特定の細胞だけに薬を効かせる技術や悪性細胞だけを細胞死誘導する技術の開発が求められています。
研究の内容
本研究では、特定のがん細胞などで発現するたんぱく質に応じて、その細胞特異的に目的とするたんぱく質(アポトーシス誘導たんぱく質など)の合成を制御できる、RNAスイッチシステムを創製しました。これまでに本研究グループは、特定のたんぱく質の発現に応答して、mRNAから目的たんぱく質の翻訳を抑制する「オフスイッチ」の開発に成功していました(図1)。今回、RNAiを制御する技術を基盤として、たんぱく質合成を活性化する「オンスイッチ」を新しく開発しました(図2)。具体的には、このオンスイッチ作成のために、細胞内で発現する特定のたんぱく質の発現に応答して、目的遺伝子(他のたんぱく質)に対するRNAiの活性を制御できる人工ショート・ヘアピンRNA(shRNA)を開発しました(図2、右)。
さらに、これら2つのRNAスイッチを細胞に内在するアポトーシスネットワークに連結し、RNAスイッチによる細胞の生死を制御するシステムの開発に取り組みました(図3)。その結果、特定のたんぱく質を発現している細胞のみ死に至らしめることを可能とする、高度な細胞生死のコントロール技術の創出に成功しました。具体的には、これらのスイッチを利用して、L7Aeとよばれるタンパク質の発現に応答してアポトーシス誘導・抑制たんぱく質の発現をON/OFF制御することにより、L7Aeの発現している細胞だけをアポトーシス誘導または抑制することに成功しました(図4)。すなわち、このRNA ON/OFFスイッチをヒト細胞に内在するアポトーシス制御システムに連結することで、細胞内の特定たんぱく質の発現に応答して、その生死を自在に決定することが可能です。
加えて、これらのON/OFFスイッチを細胞内で同時に動かし、L7Aeの発現に応答して、ある目的遺伝子は発現を抑制、別の目的遺伝子は発現を活性化させる制御を独立・協調して行うことにも成功しました(図5)。この成果は、ヒトの細胞内で、入力たんぱく質Aの情報(発現)を出力たんぱく質Bの情報(抑制・活性化)に直接変換できる「たんぱく質-たんぱく質人工情報変換システム」をRNAとたんぱく質で構築した世界で初めての例です。また、このシステムは細胞内の特定たんぱく質の発現に応答して、ヒト細胞内の異なる2つのたんぱく質の抑制/活性化を同時に制御できるシステムと捉えられ、特定たんぱく質を同時に検出し、目的の遺伝子のON/OFFを自在に制御できる汎用性の高いものです。汎用性の高さは、合成生物学や次世代バイオテクノロジーの新技術として今後応用され広がる可能性が高いことを意味しています。具体的には、L7Aeの発現に応答して、EGFPをノックダウンしていたRNAi効果が阻害され、EGFPの発現が活性化され細胞は緑の蛍光を発する(ONスイッチ)ようになっています(図5)。また、同時にL7Aeに結合するmRNAからのAsRed2(赤く光る蛍光たんぱく質)合成が抑制され、赤い蛍光が消えていく(OFFスイッチ)のが観察されました(図5)。また、蛍光たんぱく質をアポトーシス制御たんぱく質に置き換えた実験では、2つのRNAスイッチが協調して高度に細胞の生死を制御できることが示されました。そして、これらのRNAスイッチは、染色体に埋め込まれた遺伝子から発現するたんぱく質(L7Aeを分子タグとして連結)にも応答して機能し、アポトーシスを制御することができます。
今後の展望
今回開発した人工RNAスイッチによる細胞の生死を制御するシステムを用いれば、今後応答する特定たんぱく質を適切に設定することで、これまで生物の個体全体に作用していた薬効をがん細胞や特定の臓器だけに効かせることが期待されます(図6)。このような医薬が実現すれば、細胞に入ってから細胞の状態をモニターして自ら薬を効かせるべきかを判断できる、従来の薬の概念を変える副作用のない夢の医薬を作り出すことができます。また、現在の再生医療においても、神経や臓器などの特定の細胞に分化した細胞だけを効率よく選択し、培養する技術などに応用可能であり、生命科学研究の基盤的な手法へと発展していくことが見込まれます。また、本研究で開発されたRNAスイッチシステムは、RNAの配列を目的に応じて改変するだけで、研究や医療で用いられているRNAiや人工mRNAの手法全般に応用が可能な技術モデルであり、さまざまな分野で新しい研究手法として役立つ技術になり得ます。
参考図
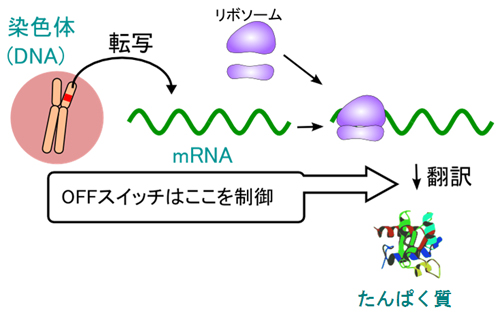
- 図1 人工RNAオフスイッチの概略
標的mRNAからたんぱく質が作られる過程(リボソームの機能)を阻害することで、たんぱく質の翻訳を抑制する。
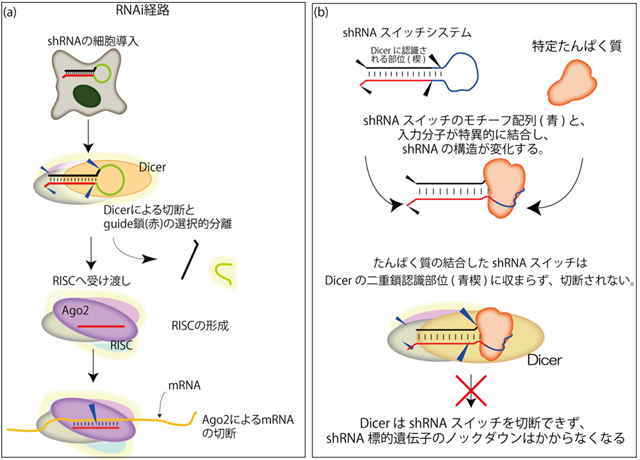
- 図2 RNAiの経路の説明(左)と開発に成功したRNAオンスイッチの仕組み(右)
(a)RNAiはヒトや植物を含むさまざまな生物種の遺伝子発現を一過的に抑制(ノックダウン)する現象で、哺乳類におけるRNAiには、shRNAという50~70塩基の比較的短いRNAが用いられる。shRNAは、目的遺伝子のmRNA(DNAからたんぱく質を合成する際の配列情報を伝えるRNA)と相補的な20塩基前後の配列(標的配列:赤線)を含む二重鎖部位と、二重鎖部位を連結するループ部位からできており、shRNAの二重鎖部位はDicerという二重鎖切断酵素に認識部位(黒楔)で切断され、RNAiの経路に導入され、目的遺伝子のmRNAを切断する。一方、ループ部位にはリンカーとしての機能しかないため、好きな配列に置換可能。
(b)このループ部位を特定のたんぱく質と結合するモチーフ配列に置換し、この結合が起こるとDicerによる認識・切断を受けなくなるよう最適化したshRNAスイッチを設計した。つまり、このshRNAスイッチは特定たんぱく質を発現している細胞ではDicerの切断を受けず、shRNAによるノックダウンがOFFになり、結果、目的遺伝子の発現をONにするRNAスイッチとなる。設計にあたり、たんぱく質結合モチーフとして枯草菌のリボソームたんぱく質L7Aeと特異的に結合する配列(キンクターン:Kt)を用いた。このshRNAスイッチが細胞内で、特定たんぱく質であるL7Aeの発現に応答して、EGFP(蛍光たんぱく質)やBcl-xL(細胞死抑制たんぱく質)のノックダウンを制御できることを確認した。
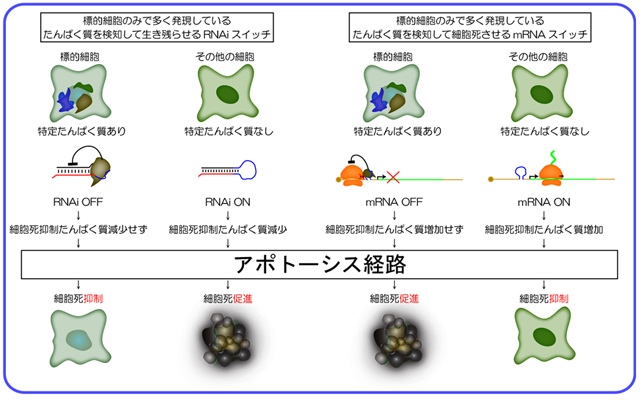
- 図3 RNAiスイッチとmRNAスイッチによる細胞の生死制御
特定たんぱく質に応答するRNAスイッチを細胞内のアポトーシス経路に接続することで、特定たんぱく質の発現している細胞だけを細胞死に誘導したり(図右、mRNAオフスイッチ)、特定たんぱく質を発現している細胞だけを生き残らせたり(図左、RNAiオンスイッチ)することができる。
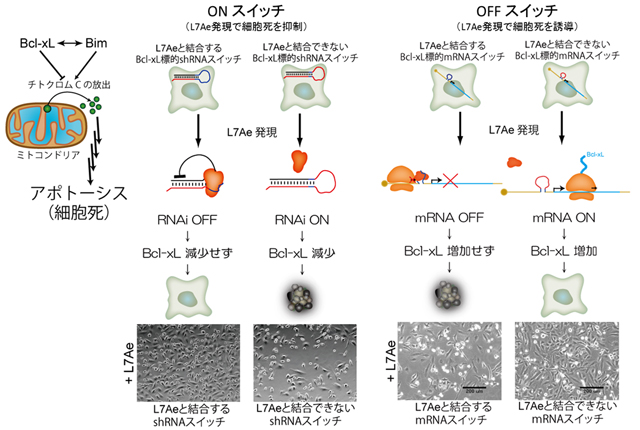
- 図4 L7Ae(特定たんぱく質)に応答したアポトーシス制御システム
RNAON/OFFスイッチがBcl-xL(アポトーシス抑制たんぱく質)の量を調節することでアポトーシスを制御できる。アポトーシスが起こるかどうかは、細胞死誘導たんぱく質であるBimと細胞死抑制たんぱく質であるBcl-xLの量のバランスが崩れることで決定する(BimよりBcl-xLが減少すると細胞死が誘導される)。特定たんぱく質であるL7Aeの発現に応答してBcl-xL(細胞死抑制たんぱく質)の発現をON(RNAiスイッチ)/OFF(mRNAスイッチ)制御することにより、L7Aeと結合できるRNAスイッチを導入した細胞だけを細胞死誘導(OFFスイッチ:mRNAスイッチ)または抑制(ONスイッチ:RNAiスイッチ)することができた。
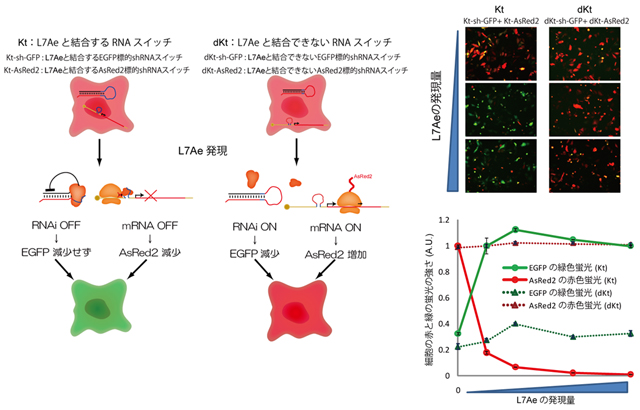
- 図5 L7Aeの発現に応答して2つのRNAスイッチが同時かつ独立にEGFPとAsRed2を制御
L7Aeと結合するRNAスイッチであるKtでは、L7Aeが発現すると、それぞれのRNAスイッチにL7Aeが結合し、EGFPのRNAiスイッチがOFFになりEGFPの発現が活性化して緑色の蛍光を発し、mRNAスイッチがOFFになりAsRed2の発現が減少して赤色の蛍光が消える。結果的に、細胞はL7Aeが発現していくと赤から緑色に変化するのが右の写真とグラフから読み取れる。一方でL7Aeが結合できないコントロールであるdKtでは、L7Aeを発現してもスイッチに変化が起きず、RNAiスイッチはEGFPの発現を抑制し続け、mRNAスイッチはAsRed2を発現し続けることで、緑色の蛍光は消え、赤色の蛍光は出続けるので、細胞は結果的にL7Aeの発現に関係なく赤く光り続けていることが読み取れる。
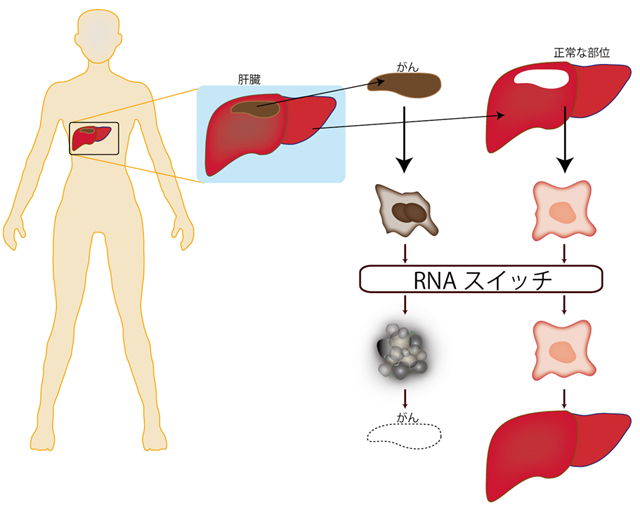
- 図6 RNA制御スイッチの将来展望
特定の標的細胞(がん細胞など)で発現するたんぱく質に応じて、その細胞特異的にRNAスイッチシステムが細胞死を起こさせ、正常な細胞には作動しないことで、標的細胞だけを取り除き、正常細胞を維持できる。
関連リンク
- 論文は、以下に掲載されております。
http://dx.doi.org/10.1038/ncomms1157 - 以下は論文の詳しい書誌情報です。
Saito H, Fujita Y, Kashida S, Hayashi K, Inoue T. Synthetic human cell fate regulation by protein-driven RNA switches. Nature Communication 2011 Jan;2(1):160.
- 朝日新聞(1月19日 28面)、日刊工業新聞(1月19日 33面)、読売新聞(3月7日 18面)および日経産業新聞(1月25日 10面)に掲載されました。

