2011年1月7日

左から、芹川忠夫 医学研究科附属
動物実験施設長/教授、庫本准教授
庫本高志 医学研究科附属動物実験施設准教授らの研究グループは、生まれつき脱髄となるラットの解析から、脱髄の原因遺伝子を突き止め、科学誌PLoS Geneticsに掲載されることになりました。
論文タイトル: A mutation in the gene encoding mitochondrial Mg2+ channel MRS2 results in demyelination in the rat
著者名:Takashi Kuramoto(1), Mitsuru Kuwamura(2), Satoko Tokuda(1, 2), Takeshi Izawa(2), Yoshifumi Nakane(1), Kazuhiro Kitada(1, 3), Masaharu Akao(4), Jean-Louis Guénet(5), Tadao Serikawa(1)
所属:(1), 京都大学大学院医学研究科附属動物実験施設、(2), 大阪府立大学獣医病理学、(3),北海道大学大学院理学研究院、(4), 京都大学大学院医学研究科循環器内科、(5), フランスパスツール研究所
研究の概要
脱髄は原因不明の難治性疾患で、いったん完成したミエリンに障害がおこる。今回我々は、生まれつき脱髄となるラットの解析から、脱髄の原因遺伝子を突き止めた。この遺伝子はミトコンドリアのマグネシウムイオンチャネルであり、脱髄ラットではこの遺伝子に異常があり、ミトコンドリアのはたらきが低下する。本研究は、ミトコンドリアの機能不全によって、脱髄が引き起こされることを初めて示したものであり、難治性疾患である脱髄の治療、診断、予防に展望をあたえる。
脱髄(demyelination)とは
いったんできあがったミエリン(髄鞘)が、何らかの原因で消失していく疾患の総称。ミエリンは神経の絶縁体で、神経伝達の速度の維持にかかせない。ミエリンが障害されることで、神経伝達速度が遅くなり、さまざまな神経症状がひきおこされる。
生まれつき脱髄になるdemyelination (dmy) ラット
バルセロナ大学で見つかった突然変異体で、京都大学で脱髄モデルとして確立された。現在は、ナショナルバイオリソースプロジェクト「ラット」(NBRP-Rat)にて系統保存されており、本研究では、NBRP-Ratからこのdmyラットの提供を受けた。生後のミエリンの発達は正常であるが、4週齢ごろより中枢神経系でのみ脱髄がみられる。脱髄は進行性で、後ろ足の麻痺をひきおこし、ラットは歩行困難に。最終的に横臥状態となり8週齢ごろまでに死亡する。Dmyラットは“脱髄遺伝子”が遺伝するために、生まれつき脱髄になることがわかっている。
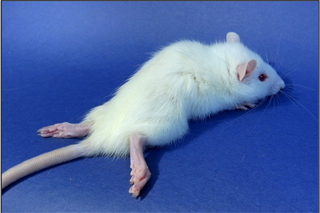 後ろ足の麻痺を示すDMYラット | 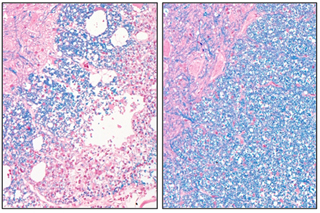 脊髄病理像:(左)DMYラット、(右)正常ラット ミエリンは青く染まっている。DMYラットではミエリンが消失している。 |
脱髄の原因遺伝子はミトコンドリアのMg2+チャネル
Dmyラットに脱髄を引き起こす遺伝子は、いったい何であろうか?この遺伝子を見つければ、脱髄の発症メカニズムが新たにわかると考えた。そこで、我々は、この脱髄遺伝子をdmy遺伝子と名付け、遺伝学的手法によりその正体を明らかにすることを企画した。交配により作り出したラット家系の遺伝解析から、dmy遺伝子はラット第17染色体の約48万塩基対の領域(ラットゲノムの約0.02%に相当)に存在することを突き止めた。この領域内には6つの遺伝子が存在していることが知られており、dmyラットでは、その中のMrs2と呼ばれる遺伝子に異常があることを発見した。
Mrs2遺伝子はミトコンドリアのMg2+チャネルを形成し、Mg2+をミトコンドリアに取り込む。Mg2+はミトコンドリアが正常に機能するために必須のイオンであり、エネルギー産生に欠かせない。
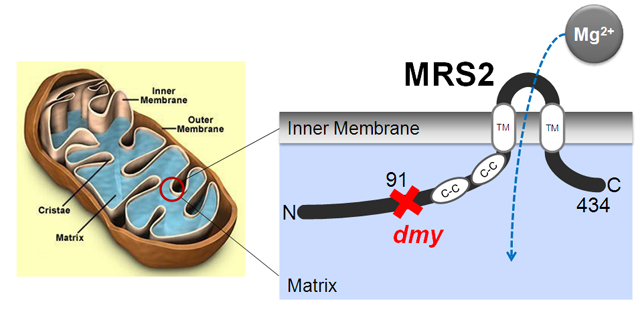 | |
| ミトコンドリアの内部構造 (Mitochondrial-Disorder-Information.comより) | MRS2タンパク質の模式図 MRS2はミトコンドリア内膜に存在する膜タンパク質。五量体を形成し、マグネシウムイオンを取り込む。DMYラットでは、91アミノ酸残基にストップコドンが入る。そのため、MRS2が作られない。 |
dmyラットはミトコンドリア異常を示す
dmyラットではMrs2遺伝子に異常があり、ミトコンドリアのマグネシウムチャネルが形成されない。そのため、dmyラットはミトコンドリア機能不全となっていると考えた。一般に、ミトコンドリア機能不全になると、脳脊髄液や血液の乳酸値の上昇やATPの減少がみられる。dmyラットにおいても、脳脊髄液中の乳酸値の大幅な上昇(正常ラットの約6倍)、脳内ATP含有量の減少(正常ラットの約3分の1)が観察された。このことから、dmyラットでは確かに中枢神経系においてミトコンドリア機能不全が生じていることがわかった。
脱髄の発症メカニズム
dmyラットにおける脱髄の発症には中枢の免疫担当細胞(ミクログリア/マクロファージ)が重要な働きをしている。というのは、dmyラットでは、脱髄の発症時期に、ミクログリアの活性化やサイトカインの上昇が見られるからである。この免疫細胞の活性化は、人の脱髄疾患でもひろく観察される現象であり、今回の研究成果から、活性化の要因として中枢神経系の細胞代謝異常が示唆された。
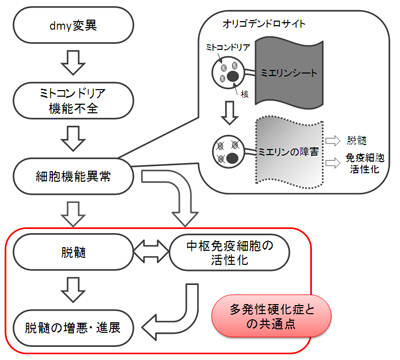
- DMYラットにおける脱髄発症のメカニズム(予想)
(左側)遺伝子レベルの変異から臨床レベルの脱髄までの発症機構を示している。
(右上の吹き出し)中枢においてミエリンを産生する細胞はオリゴデンドロサイトである。オリゴデンドロサイトの機能異常によりミエリン障害がおこり、免疫細胞を活性化するという過程が考えられる。
(下側赤枠)DMYラット、人の脱髄疾患ともに、脱髄病巣部では免疫細胞の活性化がみられる。
新規概念:ミトコンドリア機能不全が脱髄を引き起こす
本研究は、ミトコンドリアの機能不全によって、脱髄が引き起こされるという新規概念をラットモデルを用いて示した。この概念は人の脱髄疾患にも適用可能であり、この観点から、人の脱髄疾患の原因をとらえなおす必要がある。人の中枢神経系の脱髄疾患で最も多いのは多発性硬化症(特定疾患)である。その原因は不明であり、現在のところ自己免疫説が有力である。今後、多発性硬化症を含む人の脱髄疾患においてもミトコンドリア異常や代謝異常を検討する必要がある。現在、脱髄疾患の主な治療標的は免疫系であるが、神経系細胞の代謝系も標的にすることで、より効果的な治療法や予防法が開発されると期待できる。
関連リンク
- 論文は、以下に掲載されております。
http://dx.doi.org/10.1371/journal.pgen.1001262
http://hdl.handle.net/2433/134557(京都大学学術情報リポジトリ(KURENAI))
- 京都新聞(1月7日夕刊 8面)、日刊工業新聞(1月10日 11面)、日本経済新聞(1月7日夕刊 14面)、毎日新聞(1月7日夕刊 7面)および読売新聞(1月8日 2面)に掲載されました。

