2010年12月1日

左から、松村和明 再生医科学研究所
特任助教、玄准教授
玄丞烋 再生医科学研究所准教授らの研究グループの研究成果が、12月2日に東京で開催される文部科学省再生医療実現化プロジェクトの22年度成果報告会にて発表されることになりました。
研究成果の概要
背景
細胞生物学研究において、細胞の凍結保存は無くてはならない技術として広く使用されている。現在では、世界中の細胞バンクにて種々の株化細胞などが凍結保存されているだけでなく、畜産業界においては種の保存、家畜増産のための精子・卵・受精卵の凍結保存、生殖医療における生殖細胞の凍結保存など、その応用は多岐にわたっている。再生医療分野においてもヒトES/iPS細胞の臨床用バンキング構想も広く議論されている。しかしヒトES/iPS細胞の場合、凍結保存後の生存率が低いという問題点を抱えている。また細胞移植のみならず再生組織を利用した再生医療を臨床応用し、産業とするためには凍結保存の技術が必要であり、そのためにはこれまでの問題点を克服するためのブレイクスルーが必要である。すなわち、再生組織などの不均質で精緻な構造体を均一にその活性を失わずに凍結保存させる方法はまだ現実的でなく、工学と生物学、および物理学などの学際領域が一体となって研究に取り組むべき重要課題である。我々はこれまでに開発した新規凍害保護物質である、両性電解質高分子の一種のカルボキシル化ポリリジンを用いて効率の高い、毒性の低いヒトiPS細胞の凍結保存液を開発した。
ガラス化凍結保存法
細胞懸濁液にジメチルスルホキシド(DMSO)やグリセリンなどの凍害保護剤を添加し、フリーザー中で凍結するような方法は、一般に緩慢凍結法と呼ばれ、簡易にできることから研究室や細胞バンクなどで良く用いられる凍結方法である。しかし、凍結に弱いヒトESやiPS細胞、受精卵などは凍結の際の細胞内外の氷晶形成によるダメージが無視できず解凍後の生存率が非常に低い。そのような緩慢凍結が困難な細胞はガラス化法(vitrification)と呼ばれる特殊な凍結法が用いられている。ガラス化法では水を結晶化させずにガラス状態で固化、凍結する方法である。そのためには、溶質(凍害防御剤)の濃度を高めることと、冷却速度を大きくするということが必要となる。溶質の濃度が高いほど水の分子運動が制限されてガラス化しやすくなるが、一方で浸透圧が高くなり、細胞への毒性も高くなる。また、凍結時よりもむしろ溶解時に再結晶化が起こることにより細胞がダメージを受けることがより大きな問題となっている。
霊長類ES/iPS細胞の凍結保存
霊長類のES細胞やヒトのiPS細胞はマウスのものと異なり、凍結耐性が低いと言われている。ヒトES細胞やiPS細胞をコロニーの状態で緩慢法により凍結すると、解凍後のコロニー生着率や増殖率などは1%以下といった極めて低い値を示す。そこでガラス化法を用いて凍結効率を上げる試みが行われてきた。現在理化学研究所バイオリソースセンターの研究用iPSバンクではDAP213というガラス化液を用いてヒトiPS細胞をガラス化し保存している。このDAP213はマウスの受精卵の保存用に開発されたガラス化液であるが、DMSO2M、アセトアミド1M、プロピレングリコール3Mという高い溶質濃度をもつため浸透圧による毒性が非常に高く、ES/iPS細胞を凍結する際には懸濁を始めてから液体窒素に浸漬するまでに要する時間を10-30秒程度という短い時間にしなくては解凍後の生存率が大きく低下するなど、かなり手技的に熟練を要する。そのためバイオリソースセンターでは凍結融解に関して講習を開いて技術指導を行っているが、もっとハンドリングが容易で毒性が低く、効率も高い方法や、新しい凍結保存液の開発が望まれている。
新規凍結防御剤
我々は、これらの要望に応えるためDMSOに代わる毒性が低くて安全性の高い新しい凍害防御剤を検討し、開発してきた。すでに食品添加剤として広く使われているε-ポリ-L-リジン(PLL)のアミノ基を一部無水コハク酸と反応させることによりカルボキシル基を導入 した、両性イオン高分子電解質(Polyampholytes)のPLLを合成した。このカルボキシル化PLL(COOH-PLL)は、カルボキシル基の導入率に応じてそれ単体で細胞の凍害防御効果を示すことを明らかにした。カルボキシル基の導入率が65%のもの(PLL(0.65))が最も高い細胞凍結保護効果を持つことがわかった。機序に関しては低温時における細胞膜の保護作用と氷の再結晶化抑制効果が関係していると考えている。
新規凍害保存剤を用いたガラス化
既存のガラス化液を使用した方法には、安定なガラス化を得るために急速凍結および少量での凍結、さらに解凍時の再結晶化を抑制するために急激に昇温しなくてはならないなど、手技的に困難であるという問題があった。これはすなわち、凍結状態でのガラス状態の不安定さから来る問題である。そこで、我々は、上記のカルボキシル化ポリリジンの氷の再結晶化抑制効果を利用して、ガラス化液のガラス状態の安定化を試みた。まず分化に影響を及ぼすとされるDMSOと発ガン性のあるアセトアミドを使用せず、畜産業界や生殖医療現場で良く用いられているエチレングリコール(EG)とスクロースの組み合わせにより基礎となるガラス化液を選んだ。ここで濃度はEGを6.5M、スクロースを0.75Mとした。EGおよびスクロースの濃度を高めるほどガラス化能は高くなるが、同時に細胞毒性も増す。この濃度では200μLという液量でもガラス化が可能であった。そこにPLL(0.65)を10%添加したものを同時に作成し、既存のDAP213とヒトiPS細胞のガラス化凍結保存について比較検討した。このとき、PLL(0.65)を添加することにより浸透圧ショックが緩和され、ガラス化液の毒性が減少することも確認している。図1に、ガラス化液を一旦液体窒素に浸漬してガラス化させた後のPLL(0.65)の添加の有無における室温解凍時の様子を示した。どちらのガラス化液も透明なガラス状態で凍結したが、PLL(0.65)を加えないガラス化液は室温に放置することで白濁し、再結晶化が起こった。一方、PLL(0.65)を添加することにより室温においても白濁化せずに透明な状態で溶解した。示差走査熱量分析(DSC)による詳細な熱分析にてPLL(0.65)の再結晶化抑制効果を確認している。
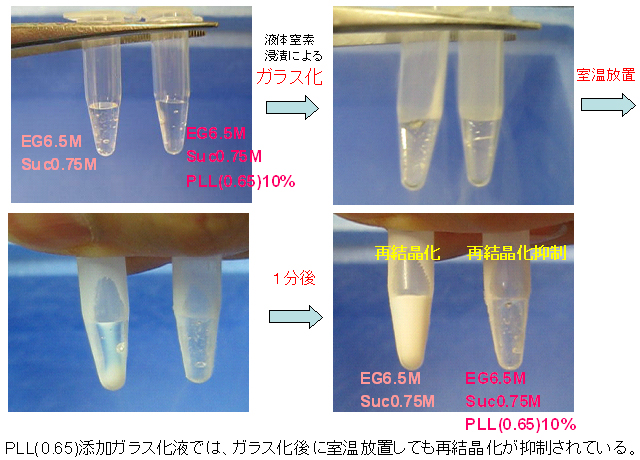
- 図1: PLL(0.65)の氷再結晶化抑制効果
そこで、これらの溶液を使用してヒトiPS細胞をガラス化保存し、解凍後のコロニー接着率と回復率を図2に示した。明らかにDAP213や、EGおよびスクロースのみの系に比べ、PLL(0.65)を添加することで有意に高い値が得られることが確認できる。また、解凍後の培養においてもアルカリフォスファターゼやOct-4、SSEA-4、TRA-1-60などの未分化マーカーの発現も維持し、さらにマウスに移植することにより奇形腫を形成することからも未分化性、多能性が凍結後にも維持されていることを確認した。つまり、今回提案した様なガラス状態を安定化させたガラス化液を用いることにより、より簡便で効率の良い方法の確立が期待され、誰でも容易にヒトES/iPSをストックし、実験に使用できるだけでなく、iPS/ES細胞の大規模保存システムを用いたバンキングへの応用も可能となると考えている。
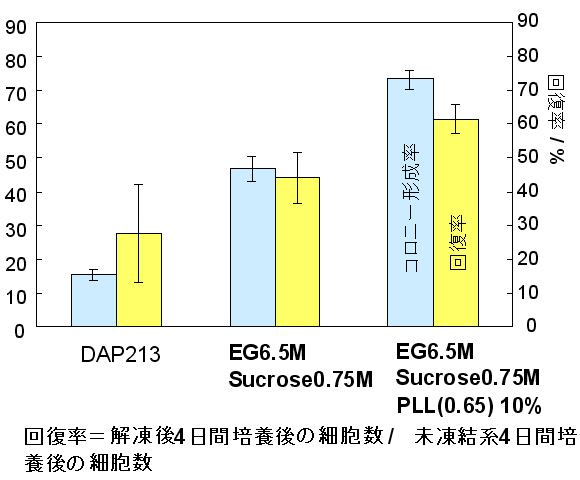
- 図2: ヒトiPS細胞の解凍後コロニー形成率と回復率
今後の展望
我々が新規に開発したε-ポリ-L-リジン(PLL)の両性イオン高分子電解質(Polyampholytes)溶液を用いた場合、凍結時のガラス状態が安定であることから大容量でのガラス化凍結保存も可能である。すなわち、今後のヒトiPS細胞のバンキングのみならず、分化誘導した細胞や組織といった再生医療用のBiobankingなどの構築にも有用である。
また、受精卵のガラス化保存にも有効なデータが出てきており、各種有用細胞の保存にも応用が期待される。
- 京都新聞(12月2日 21面)、産経新聞(12月2日 22面)、日刊工業新聞(12月2日 23面)、日本経済新聞(12月2日夕刊 18面)、毎日新聞(12月2日 4面)、読売新聞(12月3日夕刊 2面)および日経産業新聞(12月2日 11面)に掲載されました。

