2010年12月1日

植村助教
植村健吾 医学部附属病院助教らの研究グループの成果が科学誌「Nature Communications」の電子版に掲載されることになりました。
研究成果の概要
アルツハイマー病の病因仮説として、「アミロイド仮説」が知られています。このアミロイド仮説によると、神経毒性の強いアミロイドβペプチド(Aβ)が神経細胞死と脳の萎縮を起こすことが、アルツハイマー病の病因と考えられています。
Aβは、アミロイド前駆体蛋白がガンマセクレターゼという酵素で切断されることで作られます(図1)。この際に、より毒性の強いAβ42と毒性の弱いAβ40がおおよそ1:10の割合で産生されます。
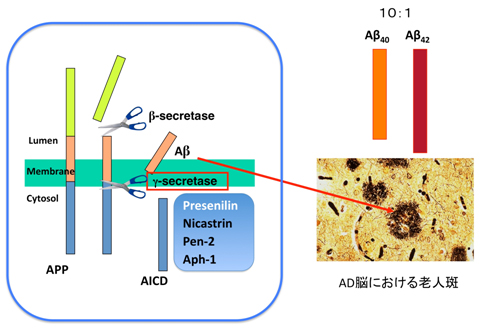
- 図1: γ-セクレターゼ:Aβ産生にかかわる“分子はさみ”
ガンマセクレターゼの活性中心が、家族性アルツハイマー病の原因遺伝子としてもしられているプレセニリン1(PS1)です。家族性アルツハイマー病の変異PS1では、この毒性の強いAβ42の産生量が増えて、Aβ42/40比が著明に上昇することが知られています。
しかしながら、アルツハイマー病のほとんどをしめる弧発例(遺伝でない症例)では、PS1は正常です。この正常のPS1がどのようにして違った割合のAβ42とAβ40を作り出しているのでしょうか?
この疑問に答える目的で、我々の研究グループは、以前にPS1の分子構造を測定できるような蛍光プローブを作り出しました。これがG-PS1-Rプローブです。このプローブでは、PS1のN末端と、PS1のループと呼ばれるドメインに蛍光物質であるGFPとRFPとがくっつけてあり、FLIM(蛍光寿命イメージング測定法)という手法を用いて、PS1のN末端とループドメイン間の距離を測定することができます(図2)。
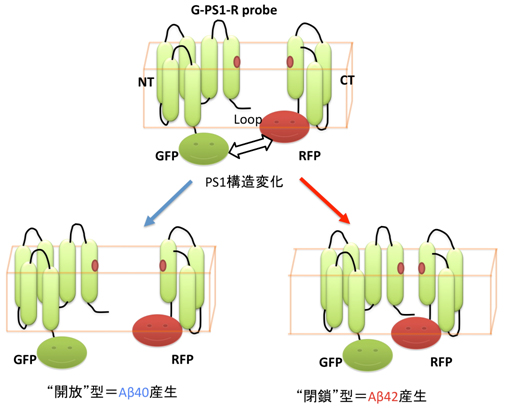
- 図2: PS1構造変化の模式図
私たちの研究グループは、このプローブを用いて、PS1の構造がAβ42/40の産生比と密接な関係にあることを、既に報告しました(Uemura et al., PlosOne 2009)。私たちの研究成果によると、PS1のN末端とループが近い“閉鎖”構造の時にはAβ42が産生されやすく、N末端とループの距離が遠い“開放”構造の時にはAβ40が産生されやすくなることが判りました(図2)。
さて、このPS1の構造を調節し、毒性の強いAβ42の産生を減少させるような薬剤があるのでしょうか?実は、そういう活性を持つことが知られている「ガンマセクレターゼ調整薬」という薬剤が知られています。この代表的なものが、意外に身近に存在しています。それは、リウマチなどの治療に使われている非ステロイド性消炎剤(NSAIDs)です。実は疫学的にも、インドメタシンなどの消炎剤を使っているリウマチの患者様はアルツハイマー病になりにくいことが知られていて、これはインドメタシンがAβ42の産生を抑えるためとも考えられています。
さて、このガンマセクレターゼ調整薬(gamma-secretase modulators: 以下GSMsと略します)がどのようにしてAβ42の産生を抑えるのかは、いままで良くわかっていませんでした。この点につき、画期的な発表が最近行われた(Kukar et al., Nature 2008)のですが、これはGSMsがAPPと結合して膜内での位置をずらしてしまうことで、Aβの長さを変化させるというものでした。
私たちのグループでは、PS1の構造変化がAβの産生様式を変えるという研究をしていましたので、PS1の構造変化にはAPPが必要なのか、実験で確認することとしました。この目的で、APPを発現していない細胞にGSMsを作用させる実験を行いました。この結果、面白いことにAPPがないと、GSMsはPS1の構造変化を起こせないことがわかりました(図3上)。これに対して、APPがもともとない細胞にAPPを発現させた後にGSMsを作用させると、GSMsはPS1の構造変化を引き起こすことができました(図3中)。
この結果を受けて、私たちのグループは、APPがPS1に結合する時に、PS1の側にGSMsがPS1に作用しやすくなるような変化がおきるのではないかと考え、次の実験をしました。この実験では、GSMsと結合できないAPPの膜内領域だけをAPPをもたない細胞にペプチドとして投与し、このペプチドが存在していればAPPがない細胞においてもGSMsはPS1の構造変化を起こせるかを調べました。驚いたことに、APPがない状況でも、APPの膜内構造を模したペプチドがあれば、GSMsはPS1の構造変化をおこせることがわかりました(図3下)。
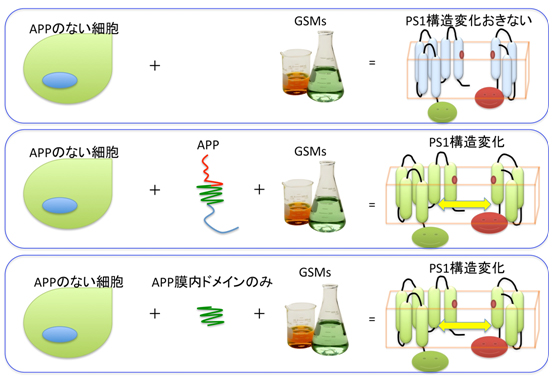
- 図3: APPの膜内ドメインがガンマセクレターゼ調整薬の働きを仲介する
以上から、私たちの研究グループでは、以下の結論を導き、Nature Communications誌に報告しました(図4)。
1)ガンマセクレターゼ調整薬は、APPではなく、直接ガンマセクレターゼに作用してPS1の構造変化を促す。
2)しかしながら、その作用には、ガンマセクレターゼとAPPのドッキングが必要なステップである。
以上の研究成果は、GSMsがAβ42を減少させるメカニズムの解明に役立ち、将来のアルツハイマー病治療薬の発見にも寄与する成果だと考えています。
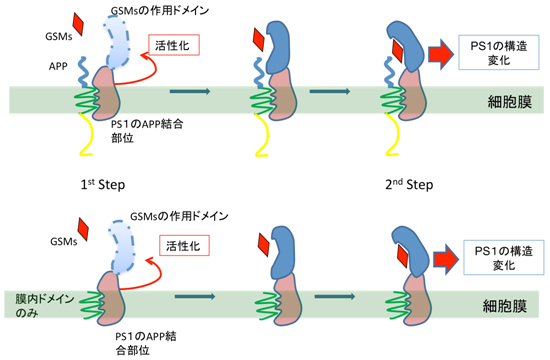
- 図4: 基質はどのようにGSMの効果を仲介するのか?
関連リンク
- 論文は、以下に掲載されております。
http://www.nature.com/ncomms/journal/v1/n8/full/ncomms1129.html - 以下は詳しい書誌情報です。
Uemura K, Farner KC, Hashimoto T, Nasser-Ghodsi N, Wolfe MS, Koo EH, Hyman BT, Berezovska O. Substrate docking to [gamma]-secretase allows access of [gamma]-secretase modulators to an allosteric site. Nat Commun 2010 Nov;1(8):130.
- 京都新聞(12月1日 23面)、日刊工業新聞(12月1日 25面)および読売新聞(12月1日夕刊 2面)に掲載されました。

